Forbrenningsprosessen og dens typer
| Parameternavn | Betydning |
| Artikkel emne: | Forbrenningsprosessen og dens typer |
| Rubrikk (tematisk kategori) | Befolkning |
Forbrenning er et av de mest interessante og vitale naturfenomenene for mennesker. Forbrenning er gunstig for en person så lenge det ikke går utover underordningen av hans rasjonelle vilje. Ellers kan det forårsake brann. En brann er en ukontrollert forbrenning utenfor en spesiell kilde, som fører til materielle skader og en trussel mot menneskers liv og helse. For å forhindre brann og eliminere den, er kunnskap om forbrenningsprosessen nødvendig.
Forbrenning- Dette kjemisk reaksjon oksidasjon, ledsaget av frigjøring av varme. For at forbrenning skal skje, er tilstedeværelsen av et brennbart stoff, et oksidasjonsmiddel og en antennelseskilde ekstremt viktig. Brannfarlig stoff- er ethvert fast, flytende eller gassformet stoff som er i stand til å oksidere med frigjøring av varme.
Oksidasjonsmidler det er klor, fluor, brom, jod, nitrogenoksider og andre stoffer. I de fleste tilfeller, under en brann, skjer oksidasjon av brennbare stoffer med atmosfærisk oksygen.
Tennkilde gir en energisk effekt på det brennbare stoffet og oksidasjonsmidlet, noe som fører til forbrenning. Tennkilder er vanligvis delt inn i åpne (lysende) - lyn, flamme, gnister, glødende gjenstander, lysstråling; og skjult (ikke-lysende) - varme fra kjemiske reaksjoner; mikrobiologiske prosesser, adiabatisk kompresjon, friksjon, påvirkninger, etc., har forskjellige temperaturer flamme og varme. Enhver tennkilde skal ha tilstrekkelig tilførsel av varme eller energi overført til de reagerende stoffene. Av denne grunn påvirker varigheten av eksponeringen for tennkilden også forbrenningsprosessen. Etter at forbrenningsprosessen begynner, støttes den av termisk stråling fra sonen,
Det brennbare stoffet og oksidasjonsmidlet dannes drivstoffsystem som må være kjemisk heterogene eller homogene. I et kjemisk heterogent system er det brennbare stoffet og oksidasjonsmidlet ikke blandet og har en grenseflate (faste og flytende brannfarlige stoffer, stråler av brennbare gasser og damper som kommer inn i luften). Når slike systemer brenner, diffunderer atmosfærisk oksygen kontinuerlig gjennom forbrenningsproduktene til det brennbare stoffet og går deretter inn i en kjemisk reaksjon. Denne typen forbrenning kalles diffusjon. Der lav, siden den bremses av diffusjonsprosessen. Hvis et brennbart stoff i gassform, damp eller støvete tilstand allerede er blandet med luft (før tenning), så er et slikt brennbart system homogent, og forbrenningsprosessen avhenger bare av hastigheten på den kjemiske reaksjonen. I dette tilfellet fortsetter forbrenningen raskt og kalles vanligvis kinetisk.
Forbrenningen skal være fullstendig og ufullstendig. Fullstendig forbrenning oppstår når oksygen kommer inn i forbrenningssonen i tilstrekkelig mengde Hvis oksygen ikke er nok til å oksidere alle produktene som deltar i reaksjonen, oppstår ufullstendig forbrenning. Produktene av fullstendig forbrenning inkluderer karbondioksid og svoveldioksid, vanndamp og nitrogen, som ikke er i stand til ytterligere oksidasjon og forbrenning. Produktene av ufullstendig forbrenning er karbonmonoksid, sot og produkter av nedbrytning av stoffet under påvirkning av varme. I de fleste tilfeller er forbrenning ledsaget av utseendet av intens lysstråling - en flamme.
Det finnes en rekke typer forbrenning: blits, tenning, tenning, selvantennelse, selvantennelse, eksplosjon.
Flash~ det brenner fort brennbar blanding uten at det dannes økt gasstrykk. Mengden varme som genereres under et blitz er ikke nok til å fortsette forbrenningen.
Brann - Dette er forekomsten av forbrenning under påvirkning av en tennkilde.
Tenning - en brann ledsaget av utseendet til en flamme. Samtidig forblir resten av massen av det brennbare stoffet relativt kaldt.
Selvantennelse- fenomenet med en kraftig økning i hastigheten på eksoterme oksidasjonsreaksjoner i et stoff, noe som fører til dets forbrenning i fravær av en ekstern tennkilde. Med tanke på avhengigheten av interne årsaker, er spontane forbrenningsprosesser delt inn i kjemiske, mikrobiologiske og termiske. Kjemisk selvantennelse oppstår fra eksponering av stoffer for oksygen i luft, vann, eller fra interaksjon av stoffer. Oljete filler, kjeledresser, bomullsull og til og med metallspon antennes spontant. Årsaken til spontan forbrenning av oljede fibrøse materialer er fordelingen av fettstoffer i et tykt lag på overflaten og absorpsjon av oksygen fra luften. Oljeoksidasjon er ledsaget av frigjøring av varme. Hvis det genereres mer varme enn varmetap til omgivelsene, kan det oppstå brann uten varmetilførsel. Noen stoffer antennes spontant når de interagerer med vann. Disse inkluderer kalium, natrium, kalsiumkarbid og alkalimetallkarbider. Kalsium antennes når det samhandler med varmt vann. Kalsiumoksid (quicklime), når det samhandler med en liten mengde vann, blir veldig varmt og kan antenne brennbare materialer i kontakt med det (for eksempel tre). Noen stoffer selvantenner når de blandes med andre. Disse inkluderer først og fremst sterke oksidasjonsmidler (klor, brom, fluor, jod), som ved kontakt med visse organiske stoffer forårsaker deres spontane forbrenning. Acetylen, hydrogen, metan, etylen og terpentin antennes spontant i lys når de utsettes for klor. Salpetersyre, som også er et sterkt oksidasjonsmiddel, kan forårsake spontan forbrenning spon, halm, bomull. Mikrobiologisk selvantennelse består i hovedsak i det faktum at med passende fuktighet og temperatur i planteprodukter, torv, intensiveres den vitale aktiviteten til mikroorganismer. Samtidig stiger temperaturen og det kan oppstå en forbrenningsprosess. Termisk spontan forbrenning oppstår som et resultat av langvarig eksponering for en liten varmekilde. I dette tilfellet brytes stoffene ned og, som et resultat av økte oksidative prosesser, selvoppvarmes. Halvtørkende vegetabilske oljer(solsikke, bomull, etc.), ricinusolje, terpentinlakk, maling og grunning, tre- og fiberplater, takpapp, nitrolinoleum og noen andre materialer og stoffer kan spontant antennes ved en omgivelsestemperatur på 80 -100 °C.
Selvantenning ‣‣‣ Dette er spontan forbrenning ledsaget av utseendet til en flamme. Faste og flytende stoffer, damper, gasser og støv blandet med luft kan selvantenne.
Eksplosjon(eksplosiv forbrenning) er en ekstremt rask forbrenning, som er ledsaget av frigjøring av en stor mengde energi og dannelse av komprimerte gasser som er i stand til å forårsake mekanisk ødeleggelse.
Typer forbrenning er preget av temperaturparametere, de viktigste er følgende. Flammepunkt - Dette er den laveste temperaturen til et brennbart stoff der det dannes damper eller gasser over overflaten som kortvarig kan blusse opp i luften fra en antennelseskilde. I dette tilfellet er dannelseshastigheten av damper eller gasser fortsatt utilstrekkelig til å fortsette forbrenningen. Flammepunkt Dette er den laveste temperaturen til et brennbart stoff der det avgir brennbare damper eller gasser med en slik hastighet at det oppstår stabil forbrenning etter antennelse fra en tennkilde. Selvantennelsestemperatur- dette er den laveste temperaturen til et stoff der det oppstår en kraftig økning i hastigheten på eksoterme reaksjoner, som ender med antennelse. Selvantennelsestemperaturen til de studerte faste brennbare materialene og stoffene er 30 - 670 °C. Mest lav temperatur Hvitt fosfor har høyest selvforbrenningshastighet, magnesium har høyest. For de fleste treslag er denne temperaturen 330 - 470 °C.
Forbrenningsprosessen og dens typer - konsept og typer. Klassifisering og funksjoner i kategorien "Forbrenningsprosess og dens typer" 2014, 2015.
1. GENERELL INFORMASJON OM FORBRENNINGSPROSESSER
Prosessene med forbrenning og eksplosjon spiller en stor rolle i menneskelivet. På den ene siden er disse prosessene mye brukt i ulike bransjer moderne utstyr og teknologi. La oss bare merke oss slike de viktigste næringene slik som termisk kraftteknikk, motorbygging, transport, rakett og luftfart, der de viktigste energikildene er kontrollerte forbrenningsprosesser. På den annen side fører forbrennings- og eksplosjonsprosesser ofte til katastrofale konsekvenser - skogbranner, eksplosjoner av dampkjeler og gassrørledninger, atomeksplosjoner etc. For å vurdere egenskapene og konsekvensene av disse fenomenene, er det nødvendig å kjenne til de grunnleggende lovene for prosessene som skjer under forbrenning og eksplosjon av forskjellige stoffer.
1.1. GRUNNLEGGENDE KONSEPT FOR FORBRENNINGS- OG EKSPLOSJONSFYSIKK
Forbrenning er komplisert fysisk kjemisk prosess, der transformasjonen av et stoff er ledsaget av intens varmefrigjøring, lys glød og varme- og masseoverføring med miljø. I de fleste tilfeller oppstår forbrenning som et resultat av eksoterm oksidasjon av et stoff som er i stand til forbrenning (drivstoff) av et oksidasjonsmiddel (luftoksygen, klor, lystgass, etc.). I dette tilfellet er to hovedkomponenter involvert i prosessen - drivstoff og oksidasjonsmiddel. Denne mekanismen tillater forbrenning av gasser, olje, bensin, parafin, tre, torv og andre brennbare stoffer - hydrokarboner som inneholder kjemisk formel karbon og hydrogen.
Imidlertid kan forbrenningsprosessen forekomme ikke bare under reaksjoner med å kombinere et brennbart stoff med et oksidasjonsmiddel, men også under andre reaksjoner forbundet med frigjøring av en betydelig mengde varme og rask kjemisk transformasjon. Disse inkluderer nedbryting av eksplosiver og ozon, samspillet mellom natrium- og bariumoksider med karbondioksid, nedbryting av acetylen, etc.
Forbrenning kan starte spontant som et resultat av selvantenning (for eksempel en haug med korn eller torv), eller initiert av tenning (bilmotorplugg, fyrstikk, gnist kortslutning, varme metalldråper under elektrisk sveising, etc.). Overgangen av en i utgangspunktet langsom kjemisk reaksjon til forbrenningsmodus skyldes den ikke-lineære avhengigheten av reaksjonshastigheten på temperaturen, bestemt av Arrhenius-loven.
Forbrenning er et kompleks av sammenhengende kjemiske og fysiske prosesser. De viktigste prosessene under forbrenning er varmeoverføring og masseoverføring (overføring av varme og materie). Den mest generelle egenskapen til forbrenning er evnen til den resulterende flammen til å bevege seg gjennom den brennbare blandingen ved å overføre varme eller ved diffusjonsoverføring av oppvarmede partikler fra forbrenningssonen til den ferske blandingen. I det første tilfellet kalles mekanismen for flammeutbredelse termisk, i det andre - diffusjon. Typisk skjer forbrenning gjennom en kombinert mekanisme, inkludert både varmeveksling og diffusjon av brennbare komponenter og forbrenningsprodukter.
Forbrenningsprosesser er preget av tilstedeværelsen av kritiske forhold for forekomst og spredning av flamme - visse faste verdier for trykk, temperatur, systemdimensjoner, sammensetningen av den brennbare blandingen, etc., når blandingen antennes, sprer flammen seg. eller går ut. I alle tilfeller er forbrenningsprosessen preget av tre stadier - utseendet, spredningen og slukkingen av flammen.
Avhengig av aggregeringstilstanden til de brennbare komponentene (oksidasjonsmiddel eller drivstoff), skilles tre typer forbrenning.
· Homogen forbrenning er forbrenning av gasser og dampformige brennbare stoffer i et gassformig oksidasjonsmiddel.
· Heterogen forbrenning – forbrenning av væske og fast brensel(brennbare stoffer) i et gassformig oksidasjonsmiddelmiljø. En type heterogen forbrenning er forbrenning av flytende drivstoffdråper.
· Forbrenning av eksplosiver og krutt.
Basert på hastigheten på flammeutbredelsen deles forbrenningen inn i deflagrasjon og detonasjon. Deflagrasjonsforbrenning er en forbrenningsmodus der flammen forplanter seg med subsonisk hastighet. Under detonasjon sprer flammen seg med supersonisk hastighet, for eksempel i luft - med en hastighet på mer enn 300 m/s. Subsonisk forbrenning er delt inn i laminær og turbulent. Hastigheten på laminær forbrenning avhenger av blandingens sammensetning, startverdiene for temperatur og trykk, samt hastigheten på kjemiske transformasjoner i flammen. I tillegg til de ovennevnte faktorene, avhenger hastigheten på forplantningen av en turbulent flamme av strømningshastigheten, graden og omfanget av turbulens.
Det begrensende tilfellet av forbrenning er en eksplosjon - en prosess med ekstremt rask frigjøring av store mengder energi. Som et resultat av eksplosjonen blir den eksplosive blandingen som fyller volumet der energien ble frigjort nesten øyeblikkelig til en svært oppvarmet gass med høyt trykk. Denne gassen utøver stor kraft på miljøet, og forårsaker dannelsen av en sjokkbølge. Ødeleggelsene forårsaket av en eksplosjon er forårsaket nettopp av virkningen av sjokkbølgen. Når du beveger deg bort fra eksplosjonsstedet mekanisk påvirkning sjokkbølgen reduseres. Kilden til eksplosjonen kan ikke bare være en kjemisk transformasjon, men også enhver høyenergiprosess (atom- eller termonukleær reaksjon, høytrykk damp i en kjele, lyn i atmosfæren, vulkanutbrudd, tsunami, meteorittfall osv.).
Typer forbrenning er en klassifisering av en fysisk og kjemisk prosess avhengig av egenskapene til dens forekomst. Inndelingen i typer kan gjøres basert på en analyse av eksogene og endogene egenskaper.
Forbrenning er en raskt forekommende kjemisk oksidasjonsreaksjon ledsaget av frigjøring av varme og glød. Et trekk ved denne prosessen er tilstedeværelsen av en kjedereaksjon av brannforplantning med akselerasjon og en økning i mengden varme som genereres når nytt materiale er involvert i prosessen.
For å sikre forbrenning må følgende faktorer være til stede:
- oksidasjonsmiddel (oftest oksygen);
- brannfarlig stoff;
- Brann.
Disse faktorene kan deles inn i to deler: betingelser og startmekanisme. De første inkluderer:
- tilstanden til miljøet;
- tilstanden til materialet.
Den viktigste miljøfaktoren er tilstedeværelsen av en slik mengde oksidasjonsmiddel som kan støtte den akselererende oksidasjonskjedereaksjonen i tilstrekkelig lang tid.
Materialet må være brannfarlig, det vil si i stand til å oksidere. Tilstanden til materialet som forbrenningsfaktor inkluderer også dets struktur. Porøst materiale brenner bedre fordi alle forhold er lagt til rette for bedre tilgang til oksidasjonsmidlet i alle stadier av prosessen.
Startmekanismen er tenning, hvoretter en kjedereaksjon av flammeutbredelse begynner. Kan være eksogen og endogen. Vanligvis begynner rask oksidasjon fra brannstiftelse, utført av mennesker eller naturlige elementer.
En person med vilje eller utilsiktet øker temperaturen på et materiale kraftig i hvilken som helst del av det, og danner en kontrollert eller ukontrollerbar (brann) spredning av flammer. Naturlige elementer er enhver kilde til høy temperatur. Vanligvis er dette vulkaner, meteoritter, lynnedslag.
Endogene årsaker til brann er overgangen av oksidasjon fra et langsomt stadium til et raskt. Vanligvis oppstår selve brannen når en stor mengde brennbart materiale plasseres i et miljø med et betydelig innhold av oksidasjonsmiddel. Et slående eksempel er spontan forbrenning av kull eller torv utvunnet fra et oksygenfritt miljø til luft.
Det er også en teori om spontan forbrenning av organisk materiale på grunn av den aktive virkningen av nedbrytende mikroorganismer. Essensen er at bakterier eller sopp, som bryter ned mye organisk materiale, kan øke temperaturen, hvoretter en flamme vises.
Imidlertid har denne teorien en feil: når temperaturen stiger til en viss grense, overopphetes mikroorganismene og stopper sin aktivitet, hvoretter temperaturen på det organiske materialet synker. I tillegg kan bakterier og sopp bare leve aktivt i et fuktig miljø der dannelsen av en flamme er umulig.
Maksimal temperaturøkning i en nedbrytende gresshaug når +60°C. Etter dette dør bakteriene enten eller går i suspendert animasjon. Etter en tid vil de overopphetede mikroorganismene erstattes av andre, men i et avkjølt underlag.
Typer forbrenning etter hastighet
Forbrenning er per definisjon en høyhastighets forplantning av en oksidasjonsreaksjon. Det er imidlertid enda flere indikatorer. Fra dette synspunktet er typer forbrenning delt inn i følgende:
- deflagrering - hastighet ca. 10 m/s;
- eksplosiv - ca 100 m/s;
- detonasjon - ca 5000 m/s.
Deflagrasjonsforbrenning er en prosess ledsaget av bevegelsen av en flamme gjennom hele materialet.
En eksplosjon er en prosess med samtidig rask oksidering av alt brennbart materiale på en gang. Det oppstår vanligvis når svært små og svært brannfarlige materialer antennes.
Detonasjon er en prosess der en sjokkbølge forplanter seg og setter i gang en oksidasjonsreaksjon. Sistnevnte støtter bevegelsen til førstnevnte på grunn av den raskt frigjorte varmen. Sjokkbølgen og eksoterme reaksjoner utvikler supersonisk hastighet, og danner detonasjon. 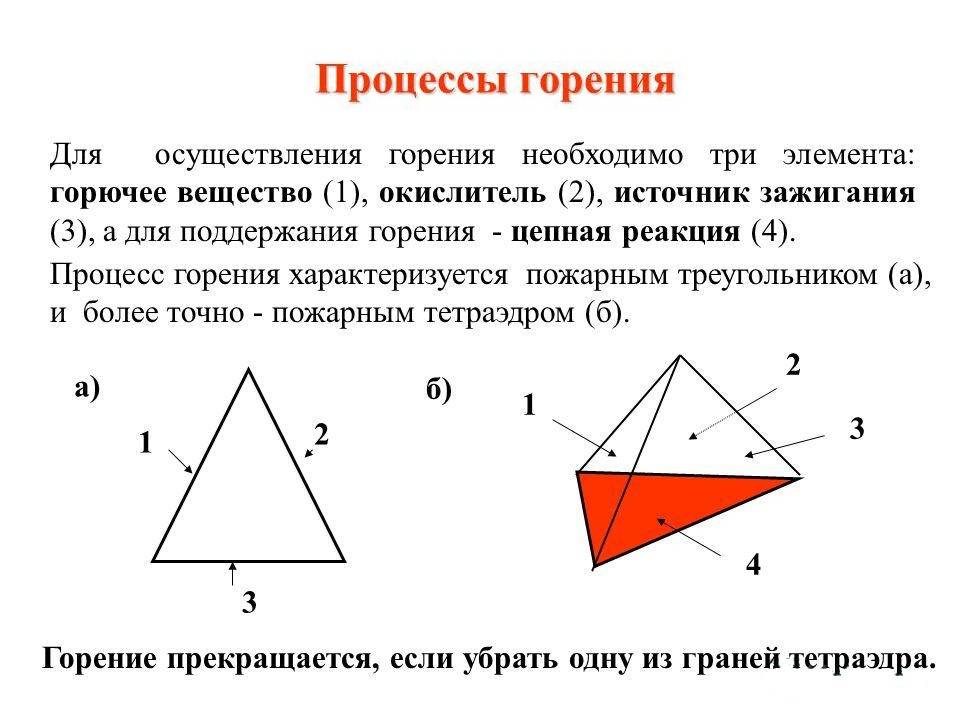
Denne klassifiseringen må ikke forveksles med typer branner. Konseptet med sistnevnte kom ikke helt fra fysikk og kjemi. Dette er en vurdering av graden av kontrollerbarhet i prosessen. Fyringen av ved i ovnen kan kontrolleres, så det er ikke brann. I motsetning til brennende gress og trær i skogen.
Varianter basert på egenskaper til brennbart materiale
Det siste stadiet av forbrenningen er forbrenning. Den er delt inn i komplett og ufullstendig. Den første er dannelsen av produkter som ikke lenger er brennbart materiale. Vanligvis er dette vann, gassformige oksider og mineraliserte faste partikler (aske, aske). Ufullstendig forbrenning skjer under forhold som hindrer spredning av brann. I dette tilfellet dannes forkullede partikler av brennbart materiale.
Ytre forhold og typer forbrenning står i et årsak-virkningsforhold. Et eksempel på dette utsagnet er inndelingen av arter i henhold til tilstanden til blandinger.
- Dårlige brannfarlige blandinger. Dette er koblingen av et materiale med et oksidasjonsmiddel der det er for få brennbare komponenter for en langvarig oksidasjonsprosess. Dette er med andre ord en blanding der det er mye oksidasjonsmiddel, men ingenting å brenne. Det motsatte er også mulig: materialet er brennbart og det er mye av det, men oksidasjonsmidlet er for lite.
- Rike blandinger. I dem fremmer forholdet mellom oksidasjonsmiddel og brennbart materiale forekomsten av stabil oksidasjon ved høye temperaturer. Denne blandingen har noe å brenne seg lenge og med stor varme. Hovedsaken er at det er nok oksidasjonsmiddel for denne prosessen.
Normalt inneholder luften ca. 21 % oksygen. Forbrenningsprosessen endrer raskt proporsjonene av luftsammensetningen. Forbrenning blir ofte umulig når oksygeninnholdet synker til 14-18 %. I disse ugunstige forhold Bare noen stoffer fortsetter å brenne, for eksempel hydrogen, etylen, acetylen. Når oksygenmengden synker til mindre enn 10 %, er forbrenning umulig for alle blandinger.
Selv om prosessen er rask, er den multifaktoriell. Dette gjør det mulig å lage et stort antall taxa og klassifikasjoner. Så mangfoldet av typer forbrenning avhenger ikke bare av miljøet og materialet, men også av menneskelig fantasi.
Denne artikkelen oppsummerer kort informasjon om forbrenningsprosessen, dens typer og årsaker. Informasjonen ble samlet inn for å gi bakgrunnskunnskap fra personer som ikke er eksperter på området. For å få mer fullstendig informasjon Det anbefales at du leser litteraturen fra listen gitt på slutten av artikkelen. Informasjon er nødvendig for å delta i en diskusjon av fakta, der fenomenet kan være spontan forbrenning av en person og gjenstander, brannpoltergeist, pyrokinesis, etc.
Forbrenning er en kompleks fysisk og kjemisk prosess for å omdanne komponentene i en brennbar blanding til forbrenningsprodukter med frigjøring av termisk stråling, lys og strålingsenergi. Forbrenningens natur kan grovt beskrives som raskt forekommende oksidasjon.
Subsonisk forbrenning (deflagrasjon), i motsetning til eksplosjon og detonasjon, skjer ved lave hastigheter og er ikke assosiert med dannelsen av en sjokkbølge. Subsonisk forbrenning inkluderer vanlig laminær og turbulent flammeutbredelse, til supersonisk - detonasjon.
Forbrenning er delt inn i termisk og kjede. Termisk forbrenning er basert på en kjemisk reaksjon som kan fortsette med progressiv selvakselerasjon på grunn av akkumulering av frigjort varme. Kjedeforbrenning oppstår i tilfeller av enkelte gassfasereaksjoner under lavtrykk.
Betingelser for termisk selvakselerasjon kan gis for alle reaksjoner med tilstrekkelig store termiske effekter og aktiveringsenergier.
Forbrenning kan starte spontant som følge av selvantenning eller startes ved antennelse. Under faste ytre forhold kan kontinuerlig forbrenning oppstå i en stasjonær modus, når hovedkarakteristikkene til prosessen - reaksjonshastighet, varmeavgivelseseffekt, temperatur og sammensetning av produkter - ikke endres over tid, eller i en periodisk modus når disse egenskapene svinge rundt deres gjennomsnittsverdier. På grunn av den sterke ikke-lineære avhengigheten av reaksjonshastigheten til temperatur, er forbrenning svært følsom for ytre forhold. Den samme forbrenningsegenskapen bestemmer eksistensen av flere stasjonære moduser under de samme forholdene (hystereseeffekt).
Følgende typer forbrenning skilles: selvantennelse, spontan forbrenning, blink, tenning, eksplosjon.
Selvantenning– forbrenning som skjer ved ekstern oppvarming av et stoff til en viss temperatur uten direkte kontakt av det brennbare stoffet med flammen til en ekstern forbrenningskilde.
Spontan forbrenning - forbrenning faste stoffer, som oppstår fra deres oppvarming under påvirkning av prosesser som skjer inne i selve stoffet. De fysiske eller kjemiske prosessene som skjer inne i stoffet er assosiert med dannelsen av varme, som akselererer oksidasjonsprosessen, som blir til forbrenning ved åpen ild.
Et blits er en rask, men, sammenlignet med en eksplosjon, kortvarig forbrenning av en blanding av damper av et brennbart stoff med luft eller oksygen, som oppstår fra en lokal temperaturøkning, som kan være forårsaket av en elektrisk gnist eller berøring av en blanding av flamme eller en oppvarmet kropp. Temperaturen der flammen oppstår kalles flammepunktet. Fenomenet med en blits ligner fenomenet med en eksplosjon, men i motsetning til sistnevnte skjer det uten sterk lyd og har ikke en ødeleggende effekt.
Antennelse er den vedvarende antennelsen av en blanding av damper og gasser av et brennbart stoff fra en lokal temperaturøkning, som kan være forårsaket av berøring av en flamme eller en oppvarmet kropp. Antenning kan vare til hele tilførselen av brennbart stoff er brent, og fordamping skjer på grunn av varmen som frigjøres under forbrenningen.
Tenning skiller seg fra et blits i sin varighet. I tillegg, under en flash, er varmefrigjøringen i hver seksjon tilstrekkelig til å antenne den tilstøtende seksjonen av den allerede tilberedte brennbare blandingen, men ikke nok til å etterfylle den ved å fordampe nye mengder drivstoff; derfor, etter å ha brukt tilførselen av brennbare damper, slukker flammen og utbruddet slutter der, til brennbare damper samler seg igjen og får lokal overoppheting. Ved antenning bringes det dampdannende stoffet til en slik temperatur at forbrenningsvarmen til den akkumulerte dampen er tilstrekkelig til å gjenopprette tilførselen til den brennbare blandingen.
En eksplosjon er øyeblikkelig forbrenning eller nedbrytning av et stoff, ledsaget av frigjøring av en enorm mengde gasser, som umiddelbart utvider seg og forårsaker en kraftig økning i trykket i miljøet. Ved kontakt med luft: gassformige nedbrytningsprodukter av noen stoffer har evnen til å antennes, noe som ikke bare fører til ødeleggelse fra virkningen av en eksplosjonsbølge, men også forårsaker store branner.
De fremhever også selvforplantende høytemperatursyntese (SHS), er en kjemisk prosess som oppstår med frigjøring av varme i en autobølgemodus som forbrenning og fører til dannelse av faste produkter. SHS er en modus for eksoterm reaksjon der varmefrigjøring er lokalisert i laget og overføres fra lag til lag ved varmeoverføring.
Brennende trekant
For at en brann skal oppstå, trengs tre faktorer: varme, oksygen og brennbart stoff (drivstoff). Poenget med spørsmålet er at bare når disse tre komponentene er tilstede i riktig proporsjon kan det oppstå en flamme.Det er også flammefri forbrenning. I motsetning til konvensjonell forbrenning, når soner med oksiderende flamme og reduserende flamme observeres, er det mulig å skape forhold for flammeløs forbrenning. Et eksempel er katalytisk oksidasjon av organiske stoffer på overflaten av en egnet katalysator, for eksempel oksidasjon av etanol på platinasvart.
En brann er en ukontrollert forbrenning utenfor en spesiell peis.

1 - drivstoff; 2 - oksygen; 3 - varm
1. Brennbart stoff (drivstoff)
Brennbare stoffer (materialer) er stoffer (materialer) som er i stand til å samhandle med et oksidasjonsmiddel (luftoksygen) i forbrenningsmodus. Basert på brennbarhet er stoffer (materialer) delt inn i tre grupper:
- ikke-brennbare stoffer og materialer som ikke er i stand til spontan forbrenning i luft;
- lavt antennelige stoffer og materialer - i stand til å brenne i luft når de utsettes for ekstra energi fra en antennelseskilde, men ikke i stand til å brenne uavhengig etter at den er fjernet;
- brennbare stoffer og materialer – i stand til å brenne uavhengig etter antennelse eller selvantennelse.
Blant brennbare stoffer er det stoffer (materialer) i ulike aggregeringstilstander: gasser, damper, væsker, faste stoffer (materialer), aerosoler. Nesten alle organiske kjemikalier er brannfarlige. Blant uorganiske kjemikalier er det også brennbare stoffer (hydrogen, ammoniakk, hydrider, sulfider, azider, fosfider, ammoniakk av forskjellige grunnstoffer).
Brennbare stoffer (materialer) er preget av indikatorer brannfare. Ved å introdusere ulike tilsetningsstoffer (promotere, brannhemmere, inhibitorer) i sammensetningen av disse stoffene (materialene), kan brannfareindikatorene deres endres i en eller annen retning.
2. Oksidasjonsmiddel
Oksyderen er den andre siden av forbrenningstrekanten. Vanligvis fungerer luftoksygen som et oksidasjonsmiddel under forbrenning, men det kan også være andre oksidasjonsmidler - nitrogenoksider, etc.
En kritisk indikator for luftoksygen som oksidasjonsmiddel er konsentrasjonen i luftmiljø lukket skipsrom innenfor volumetriske grenser over 12-14 %. Under denne konsentrasjonen skjer ikke forbrenning av det absolutte flertallet av brennbare stoffer. Noen brennbare stoffer kan imidlertid brenne ved lavere oksygenkonsentrasjoner i det omkringliggende gass-luftmiljøet.
3. Antennelsestemperatur (varme)
Det er mange konsepter som gjelder temperaturer der brann er mulig. Den viktigste av dem:
Flammepunkt er den laveste temperaturen der et stoff avgir nok brennbare damper til å antennes når det utsettes for åpen flamme, men forbrenningen fortsetter ikke.
Flammepunkt er den laveste temperaturen der et stoff produserer tilstrekkelig brennbare damper til å antennes og fortsette å brenne når en åpen flamme påføres.
Merk. Det kan bemerkes at forskjellen mellom flammepunkt og forbrenningstemperatur er at i førstnevnte er det et øyeblikkelig flamme, mens i sistnevnte må temperaturen være høy nok til å produsere nok brennbare damper til forbrenning, uavhengig av tennkilde.
Selvantenning- dette er den raske selvakselerasjonen av en eksoterm kjemisk reaksjon, som fører til utseendet til en lys glød - en flamme. Selvantennelse oppstår som et resultat av at når materialet oksideres av atmosfærisk oksygen, genereres det mer varme enn det som kan fjernes utenfor det reagerende systemet. For flytende og gassformige brannfarlige stoffer skjer dette ved kritiske temperatur- og trykkparametere.
Brennende intensitetskurve
Det er viktig å forstå hvordan en brann typisk utvikler seg. Hvis eksplosjoner og blink er utelukket, kan forbrenningsprosessen deles inn i følgende fire perioder:
1 - solingsperiode; 2 - brannutvikling; 3 - forbrenningsperiode; 4 - forfallsperiode
I denne forbindelse er det viktig at en brann vanligvis sprer seg oppover veldig raskt, til siden med relativt lav hastighet og nedover veldig sakte.
Dette kan illustreres som følger: Hvis det har oppstått en brann (trekanten er lukket), bør tiltak for å slukke brannen være rettet mot å bringe trekantens indikatorer (minst én) utover de kritiske verdiene - bryte forbrenningstrekanten . Det er det det er teoretisk grunnlag brenning og slukking.
Avhengig av aggregeringstilstanden til de brennbare komponentene (oksidasjonsmiddel eller drivstoff), skilles tre typer forbrenning.
- Homogen forbrenning er forbrenning av gasser og dampformige brennbare stoffer i et gassformig oksidasjonsmiddel.
- Heterogen forbrenning er forbrenning av flytende og fast brensel (brennbare stoffer) i et gassformig oksidasjonsmiddel. En type heterogen forbrenning er forbrenning av flytende drivstoffdråper.
- Forbrenning av eksplosiver og krutt.
Selvantennelse
Spontan forbrenning, forekomsten av forbrenning som et resultat av selvoppvarming av brennbare faste materialer forårsaket av selvakselerasjon av eksoterme stoffer i dem. reaksjoner. Spontan forbrenning oppstår på grunn av at varmeavgivelsen under reaksjoner er større enn varmeavgivelsen til miljøet.Begynnelsen av spontan forbrenning er preget av selvoppvarmingstemperaturen (Tsn), som er minimumstemperaturen under eksperimentelle forhold der varmeavgivelsen oppdages.
Når selvoppvarmingsprosessen når en viss temperatur, kalt den spontane forbrenningstemperaturen (Tsvoz), oppstår forbrenning av materialet, manifestert enten ved ulmende eller flammende forbrenning. I sistnevnte tilfelle er Tsvoz tilstrekkelig til selvantennelsestemperaturen (Tsv), som i brannslukking forstås som forekomsten av forbrenning av gasser og væsker ved oppvarming til en viss kritisk temperatur. (se Tenning ved brannslukking). I prinsippet er spontan forbrenning og selvantennelse like i fysisk essens og skiller seg bare i typen forbrenning skjer bare i form av flammende forbrenning.
Ved selvantennelse utvikles selvoppvarming (pre-eksplosiv oppvarming) innen bare noen få grader og tas derfor ikke hensyn til ved vurdering av brann- og eksplosjonsfare for gasser og væsker. Under spontan forbrenning kan det selvoppvarmende området nå flere hundre grader (for eksempel for torv fra 70 til 225 ° C). Som et resultat blir fenomenet selvoppvarming alltid tatt i betraktning når man bestemmer tendensen til faste stoffer til spontan forbrenning
Spontan forbrenning studeres ved å termostatere materialet som studeres ved en gitt temperatur og etablere forholdet mellom temperaturen der forbrenningen skjer, størrelsen på prøven og tiden den varmes opp i termostaten.
Prosessene som oppstår under spontan forbrenning av prøver av brennbart materiale er vist i figuren. Ved temperaturer opp til Tсн (for eksempel T1) varmes materialet opp uten endringer (ingen varmeutvikling). Når Tcn er nådd, oppstår eksoterme reaksjoner i materialet. Sistnevnte, avhengig av forholdene for varmeakkumulering (masse av materialet, pakningstetthet av dets atomer og molekyler, varighet av prosessen, etc.) kan, etter en periode med lett selvoppvarming ved utmattelse av materialkomponentene i stand til av selvoppvarming, avslutt med avkjøling av prøven til termostatens starttemperatur (kurve 1) eller fortsett selvoppvarming opp til Tair (kurve 2). Området mellom Tsn og Tsvoz er potensielt brannfarlig, under Tsn er trygt.

Endring i temperatur T over tid t i termostaterte prøver av brennbart materiale.
Muligheten for spontan forbrenning av et materiale som befinner seg i et potensielt brannfarlig område er etablert ved å bruke ligningene:
der Tamb er omgivelsestemperaturen, °C; l-bestemme størrelsen (vanligvis tykkelsen) på materialet; t er tiden selvantennelse kan skje; A1, n1 og A2, n2-koeffisient, bestemt for hvert materiale i henhold til eksperimentelle data (se tabell).
Bruk ligning (1) for en gitt l, finn Tam ved hvilken selvantennelse kan oppstå av dette materialet, i henhold til ligning (2) - med kjent Tam-verdi m Ved en temperatur lavere enn beregnet Tamb, eller ved m mindre enn tiden beregnet i henhold til ligning (2), vil selvantennelse ikke forekomme.
Avhengig av arten av den innledende prosessen som forårsaket selvoppvarming av materialet og verdiene til Tсн, kjemisk, mikrobiologiske og termisk spontan forbrenning.
TIL kjemisk spontan forbrenning inkludere eksoterm interaksjon av stoffer (for eksempel når konsentrert HNO3 kommer på papiret, sagflis og så videre.). Det mest typiske og utbredte eksemplet på en slik prosess er spontan forbrenning av oljete filler eller andre fibrøse materialer med en utviklet overflate. Spesielt farlig er oljer som inneholder forbindelser med umettede kjemiske bindinger og preget av et høyt jodtall (bomull, solsikke, jute, etc.). Fenomenene kjemisk selvantennelse inkluderer også forbrenning av en rekke stoffer (for eksempel finknust Al og Fe, hydrider av Si, B og noen metaller, organometalliske forbindelser - organoaluminium, etc.) når de kommer i kontakt med luft i fravær av oppvarming. Stoffers evne til å selvantenne under slike forhold kalles pyroforisitet. Det særegne med pyrofore stoffer er at deres Tabs (eller Tsb) er lavere romtemperatur: -200°C for SiH4, -80°C for A1(C2H5)3. For å forhindre kjemisk spontan forbrenning er prosedyren for felles lagring av brennbare stoffer og materialer strengt regulert.
Det er også en type kjemisk reaksjon av stoffer som er forbundet med interaksjon med vann eller fuktighet. Samtidig frigjøres også en temperatur som er tilstrekkelig for selvantennelse av stoffer og materialer. Eksempler inkluderer stoffer som kalium, natrium, kalsiumkarbid, brent kalk osv. Et trekk ved jordalkalimetaller er deres evne til å brenne selv uten tilgang til oksygen. De produserer oksygenet som er nødvendig for reaksjonen selv ved å spalte luftfuktighet til hydrogen og oksygen under påvirkning av høy temperatur. Det er grunnen til at slukking av slike stoffer med vann fører til en eksplosjon av det resulterende hydrogenet.
Tendens til mikrobiologisk spontan forbrenning har brennbare materialer, spesielt fuktede, som tjener som grobunn for mikroorganismer hvis vitale aktivitet er forbundet med frigjøring av varme (torv, sagflis, etc.). Av denne grunn oppstår et stort antall branner og eksplosjoner når landbruksprodukter (for eksempel ensilasje, fuktet høy) lagres i heiser. Mikrobiologisk og kjemisk spontan forbrenning er preget av det faktum at Tsn ikke overskrider de vanlige verdiene av Tocr og kan være negativ. Materialer med Tsn over romtemperatur er i stand til termisk spontan forbrenning.
Generelt er mange faste materialer med en utviklet overflate (for eksempel fibrøs), samt noen flytende og smeltende stoffer som inneholder umettede forbindelser avsatt på en utviklet (inkludert ikke-brennbar) overflate, utsatt for alle typer spontan forbrenning. Beregningen av kritiske forhold for kjemisk, mikrobiologisk og termisk selvforbrenning utføres ved bruk av ligning (1) og (2). På grunn av jordens tyngdekraft oppstår konveksjon (luftbevegelse) under forbrenning: oppvarmet luft blir lettere og suser oppover, og kald luft nedenfra erstatter den. Denne luftstrømmen resulterer i en betydelig temperaturgradient langs flammen.
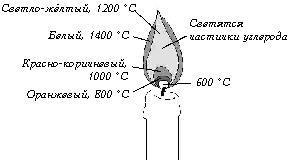
Skjematisk fremstilling av en stearinlysflamme som viser temperaturen på de forskjellige punktene når den brenner under normale forhold
Derfor ser en lysflamme i null tyngdekraft litt annerledes ut:

Gul-oransje farge på toppen av flammen i normale forhold forårsaket av gløden fra sotpartikler båret oppover av en stigende strøm av varm luft. Sot er mikropartikler som inneholder karbon som ikke har rukket å brenne, dvs. bli til CO2. I null tyngdekraft er lysflammen mindre og ikke så varm som vanlig, fordi... det er ikke nok frisk luft som inneholder oksygen. Derfor er det veldig lite sot, fordi det dannes ikke ved temperaturer under 1000 °C. Men selv om det var nok av det, selv da, på grunn av den lave temperaturen, ville det gløde i det infrarøde området, noe som betyr at fargen på flammen i vektløshet alltid er blåaktig.
Også fargen på flammen avhenger av hvilke elementer som "brenner" i den. Varme flamme lar atomer hoppe i noen tid til høyere energitilstander, og deretter, tilbake til sin opprinnelige tilstand, sende ut lys med en viss frekvens, som tilsvarer strukturen til de elektroniske skallene til et gitt element. For eksempel, gassbrenner brenner med en blå flamme på grunn av tilstedeværelsen av CO, karbonmonoksid, og fyrstikkens gul-oransje flamme forklares av tilstedeværelsen av natriumsalter i veden.
8. Nr. 02/2006 av tidsskriftet "Fysikk" til forlaget "Første september". Magasinets nettsted:
Forbrenning
Forbrenning- en kompleks fysisk og kjemisk prosess for å konvertere komponentene i en brennbar blanding til forbrenningsprodukter med frigjøring av termisk stråling, lys og strålingsenergi. Forbrenningens natur kan beskrives som raskt forekommende oksidasjon.
Subsonisk forbrenning (deflagrasjon), i motsetning til eksplosjon og detonasjon, skjer ved lave hastigheter og er ikke assosiert med dannelsen av en sjokkbølge. Subsonisk forbrenning inkluderer normal laminær og turbulent flammeutbredelse, og supersonisk forbrenning inkluderer detonasjon.
Forbrenning er delt inn i termisk Og kjede. I kjernen termisk Forbrenning er en kjemisk reaksjon som kan fortsette med progressiv selvakselerasjon på grunn av akkumulering av frigjort varme. Kjede forbrenning skjer ved enkelte gassfasereaksjoner ved lavt trykk.
Betingelser for termisk selvakselerasjon kan gis for alle reaksjoner med tilstrekkelig store termiske effekter og aktiveringsenergier.
Forbrenning kan starte spontant som følge av selvantenning eller startes ved antennelse. Under faste ytre forhold kan det oppstå kontinuerlig forbrenning i stasjonær modus, når hovedkarakteristikkene til prosessen - reaksjonshastighet, varmeavgivelseskraft, temperatur og sammensetning av produkter - ikke endres over tid, eller periodisk modus når disse egenskapene svinger rundt deres gjennomsnittsverdier. På grunn av den sterke ikke-lineære avhengigheten av reaksjonshastigheten til temperatur, er forbrenning svært følsom for ytre forhold. Den samme forbrenningsegenskapen bestemmer eksistensen av flere stasjonære moduser under de samme forholdene (hystereseeffekt).
Forbrenningsprosessen er delt inn i flere typer: flash, forbrenning, tenning, spontan forbrenning, spontan antennelse, eksplosjon og detonasjon. I tillegg er det spesielle typer forbrenning: ulming og kaldflammeforbrenning. Flash er prosessen med øyeblikkelig forbrenning av damper fra brennbare og brennbare væsker forårsaket av direkte eksponering for en antennelseskilde. Forbrenning er fenomenet med forbrenning som skjer under påvirkning av en tennkilde. Tenning er en brann ledsaget av utseendet til en flamme. Samtidig forblir resten av massen av det brennbare stoffet relativt kaldt. Spontan forbrenning er et fenomen med en kraftig økning i hastigheten på eksoterme reaksjoner i et stoff, noe som fører til forbrenning i fravær av en tennkilde. Spontan forbrenning er spontan forbrenning ledsaget av utseendet til en flamme. I produksjonsforhold Sagflis og oljete filler kan selvantenne. Bensin og parafin kan antennes spontant. Eksplosjon er en rask kjemisk transformasjon av et stoff (eksplosiv forbrenning), ledsaget av frigjøring av energi og dannelse av komprimerte gasser som er i stand til å produsere mekanisk arbeid.
Flammefri brenning
I motsetning til konvensjonell forbrenning, når soner med oksiderende flamme og reduserende flamme observeres, er det mulig å skape forhold for flammeløs forbrenning. Et eksempel er katalytisk oksidasjon av organiske stoffer på overflaten av en passende katalysator, slik som oksidasjon av etanol på platinasvart.
Fastfase forbrenning
Dette er eksoterme autobølgeprosesser i blandinger av uorganiske og organiske pulvere, som ikke er ledsaget av merkbar gassutvikling, og som fører til produksjon av utelukkende kondenserte produkter. Gass- og væskefaser dannes som mellomstoffer som gir masseoverføring, men som ikke forlater brennsystemet. Det er kjente eksempler på reagerende pulvere hvor dannelsen av slike faser ikke er påvist (tantal-karbon).
De trivielle begrepene "gassløs forbrenning" og "solid flamme forbrenning" brukes synonymt.
Et eksempel på slike prosesser er SHS (self-propagating high-temperature synthesis) i uorganiske og organiske blandinger.
Ulmende
En type forbrenning hvor det ikke dannes flamme, og forbrenningssonen sprer seg sakte gjennom materialet. Ulming oppstår typisk i porøse eller fibrøse materialer som har høyt luftinnhold eller er impregnert med oksidasjonsmidler.
Autogen forbrenning
Selvopprettholdende forbrenning. Begrepet brukes i avfallsforbrenningsteknologier. Muligheten for autogen (selvbærende) forbrenning av avfall bestemmes av det maksimale innholdet av ballastkomponenter: fuktighet og aske. Basert på mange års forskning foreslo den svenske forskeren Tanner å bruke et trekantdiagram med grenseverdier for å bestemme grensene for autogen forbrenning: mer enn 25 % brennbart, mindre enn 50 % fuktighet, mindre enn 60 % aske.
se også
Notater
Linker
Wikimedia Foundation. 2010.
Synonymer:Se hva "Forbrenning" er i andre ordbøker:
En fysisk og kjemisk prosess der transformasjonen av et stoff er ledsaget av intens frigjøring av energi og varme og masseutveksling med miljøet. Forbrenning kan starte spontant som følge av selvantenning eller startes... ... Stor encyklopedisk ordbok
BRENNER, brenner, mange. nei, jfr. (bok). Handling og tilstand etter kap. brenne. Gassbrenning. Mental brenning. Ordbok Ushakova. D.N. Ushakov. 1935 1940 ... Ushakovs forklarende ordbok
Skinne, lek, entusiasme, utstråling, lek, ta av, oppstemthet, oppløftende ånd, gnist, gnist, besettelse, ild, lidenskap, glimt, inspirasjon, gnist, inspirasjon, lidenskap, glede, fascinasjon, forbrenning, stige Ordbok... . .. Synonymordbok
Forbrenning- FORBRENNING, en kjemisk transformasjon som er ledsaget av intens frigjøring av varme og varme og masseoverføring med miljøet. Kan starte spontant (spontan forbrenning) eller som følge av antennelse. Den karakteristiske egenskapen til forbrenning er evnen... ... Illustrert encyklopedisk ordbok
Kompleks kjemi en reaksjon som skjer under forhold med progressiv selvakselerasjon assosiert med akkumulering av varme eller katalyserende reaksjonsprodukter i systemet. Med G. kan høye temperaturer (opptil flere tusen K) oppnås, og oppstår ofte... ... Fysisk leksikon




