Den viktigste kvalitative egenskapen til forbrenningsprosessen i ovner er dens kjemiske fullstendighet med et minimumsoverskudd av luft, som tilsvarer den høyeste forbrenningstemperaturen. Derfor, når du utfører forbrenningsprosessen, er det nødvendig å systematisk overvåke sammensetningen av forbrenningsprodukter og bestemme koeffisienten for overflødig luft og den kjemiske ufullstendigheten av forbrenningen. For dette formål brukes gassanalyse, utført ved bruk av gassanalysatorer. ulike systemer og basert på en beregningsmetode basert på den grunnleggende forbrenningsligningen.
La oss vurdere ligningen for fullstendig forbrenning. Utledningen av denne ligningen basert på balansen av oksygen i forbrenningsprodukter ble gitt av D. M. Khzmalyan [L. 4].
Under fullstendig forbrenning forbrukes oksygenet i luften som tilføres som oksidasjonsmiddel for forbrenning av karbon, svovel og fritt hydrogen i drivstoffet med dannelse av karbondioksid, svoveldioksid, vanndamp, og overskuddsdelen forblir i fri form , dvs.:
K. =0,2"/. = C + C + C, O + ^o,- (2-42)
I formelen:
Uv og U®a - mengden luft som tilføres for å brenne 1 kg drivstoff, og mengden oksygen som finnes i det, m3/kg;
C. Ud*0 - henholdsvis oksygenforbruk for dannelse av karbondioksid, svoveldioksid og for forbrenning av fritt hydrogen under forbrenning av 1 kg drivstoff, m*/kg;
U0a er mengden fritt oksygen, m3/kg.
I henhold til støkiometriske ligninger (2-1) og (2-2), med fullstendig forbrenning av drivstoff, er oksygenforbruket for forbrenning av karbon lik volumet av dannet karbondioksid, og oksygenforbruket for forbrenning av svovel er lik volumet dannet svoveldioksid, dvs.
Ус°2 = V У50* - V
IOA уСОа» кОа
Derfor er oksygenforbruket for forbrenning av karbon og svovelbrensel lik
C+C^ae. + '^^o,- (2-43)
Ved å erstatte (2-43) transformerer vi likning (2-42) til formen:
K. = 0,21V, = V + V™ + V (2-42a)
Nitrogen i luften går over i forbrenningsprodukter. Mengden bestemmes av summen av den teoretiske og overskytende mengden nitrogen V°Ma og
Y£°, og neglisjerer mengden nitrogen som forgasses fra drivstoffet på grunn av dets lave innhold i fast og flytende drivstoff(mindre
1,5-1,8 %). Overskudd av nitrogen sammen med fritt oksygen V0a
Representerer overflødig luft (a-1)°. Ved å sammenligne den totale luftstrømmen for de gitte komponentene av oksygen og nitrogen med mengden tørre gasser bestemt av formel (2-12), kommer vi til den konklusjon at
^ = Oss. g + Uo;°- (2-44)
Etter å ha erstattet (2-44) i ligning (2-42a) får vi:
Ved å uttrykke alle begrepene inkludert i ligning (2-45) som en prosentandel av volumet av tørre gasser og forenkle det, får vi:
21 = 1?02 + 02 + 79 . (2-46)
Uttrykke volumet av tørre gasser gjennom volumet av triatomiske gasser Vc. g = = vi omskriver ligningen (2-46) i form av den såkalte ligningen
Komplette forbrenningsforhold:
21 = IOg + Og + pIOg, ($2-47
Der p betyr
T/NaO T/NaO
Substituere i (2-48) i henhold til ligning (2-3) verdien for 1^*°, forutsatt at en del av hydrogenet oksideres på grunn av brennstoffoksygen, og verdien for i henhold til (2-7), uttrykket for p kan representeres gjennom den elementære sammensetningen av drivstoffet i formen:
P = 2,35<2-48а?
Den fysiske betydningen av koeffisienten p (2-48) er at den viser forholdet mellom luftoksygenforbruk for oksidasjon av fritt drivstoffhydrogen (dvs. drivstoffhydrogen, unntatt dens del assosiert med drivstoffoksygen) 0,01 (nr. -0,126 eller) til forbruket av oksygen for dannelse av triatomære gasser.
Basert på den kjente prosentandelen av O2 i forbrenningsprodukter og koeffisienten p, ved hjelp av ligning (2-47), er det mulig å bestemme prosentandelen av triatomære gasser:
Ved 02-0, dvs. ved a-1, når I02-innholdet sin maksimale verdi
VD "a": = t|t. (2-50!
Hvis de brennbare komponentene i drivstoffet var karbon og svovel, og det ikke var oksygen og hydrogen i det, eller hvis det var så mye hydrogen at det kunne oksideres på grunn av oksygenet i drivstoffet, så ved fullstendig forbrenning av drivstoffet med den teoretisk nødvendige mengden luft, vil innholdet av triatomiske gasser være 21 %, slik som i dette tilfellet i (2-50) i henhold til (2-48a) p = 0.
Fast og flytende brensel inneholder vanligvis mindre oksygen enn det som kreves for fullstendig oksidasjon av hydrogen, derfor vil en del av oksygenet i luften forbrukes for oksidering av fritt hydrogen 0,01 (Hp-0,126 0p) av drivstoffet. Derfor vil I02-innholdet i tørre gasser være mindre enn 21 % og kan bestemmes av (2-49).
Som man kan se av uttrykk (2-48a) og (2-49), er koeffisienten p og størrelsen på IOg kun avhengig av den elementære kjemiske sammensetningen til brenselet og er derfor viktige egenskaper ved drivstoffet. Verdiene av P og I02max for noen drivstoff er gitt i tabellen. 2-3.
|
Koeffisient (3 og verdi 102aKS for noen drivstoff
|
Den viktigste kvalitative egenskapen til forbrenningsprosessen i ovner er dens kjemiske fullstendighet med et minimumsoverskudd av luft, som tilsvarer den høyeste forbrenningstemperaturen. Derfor, når du utfører forbrenningsprosessen, er det nødvendig å systematisk overvåke sammensetningen av forbrenningsprodukter og bestemme koeffisienten for overflødig luft og den kjemiske ufullstendigheten av forbrenningen. Til dette formål brukes gassanalyse, utført ved bruk av gassanalysatorer av ulike systemer og basert på en beregningsmetode basert på den grunnleggende forbrenningsligningen.
La oss vurdere ligningen for fullstendig forbrenning. Utledningen av denne ligningen basert på balansen av oksygen i forbrenningsprodukter ble gitt av D. M. Khzmalyan [L. 4].
Under fullstendig forbrenning forbrukes oksygenet i luften som tilføres som oksidasjonsmiddel for forbrenning av karbon, svovel og fritt hydrogen i drivstoffet med dannelse av karbondioksid, svoveldioksid, vanndamp, og overskuddsdelen forblir i fri form , dvs.:
K. =0,2"/. = C + C + C, O + ^o,- (2-42)
I formelen:
Uv og U®a - mengden luft som tilføres for å brenne 1 kg drivstoff, og mengden oksygen som finnes i det, m3/kg;
C. Ud*0 - henholdsvis oksygenforbruk for dannelse av karbondioksid, svoveldioksid og for forbrenning av fritt hydrogen under forbrenning av 1 kg drivstoff, m*/kg;
U0a er mengden fritt oksygen, m3/kg.
I henhold til støkiometriske ligninger (2-1) og (2-2), med fullstendig forbrenning av drivstoff, er oksygenforbruket for forbrenning av karbon lik volumet av dannet karbondioksid, og oksygenforbruket for forbrenning av svovel er lik volumet dannet svoveldioksid, dvs.
Ус°2 = V У50* - V
IOA уСОа» кОа
Derfor er oksygenforbruket for forbrenning av karbon og svovelbrensel lik
C+C^ae. + "^^o,- (2-43)
Ved å erstatte (2-43) transformerer vi likning (2-42) til formen:
K. = 0,21V, = V + V™ + V (2-42a)
Nitrogen i luften går over i forbrenningsprodukter. Mengden bestemmes av summen av den teoretiske og overskytende mengden nitrogen V°Ma og
Y£°, og neglisjerer mengden nitrogen som forgasses fra drivstoffet på grunn av dets lave innhold i fast og flytende brensel (mindre
1,5-1,8 %). Overskudd av nitrogen sammen med fritt oksygen V0a
Representerer overflødig luft (a-1)°. Ved å sammenligne den totale luftstrømmen for de gitte komponentene av oksygen og nitrogen med mengden tørre gasser bestemt av formel (2-12), kommer vi til den konklusjon at
^ = Oss. g + Uo;°- (2-44)
Etter å ha erstattet (2-44) i ligning (2-42a) får vi:
Ved å uttrykke alle begrepene inkludert i ligning (2-45) som en prosentandel av volumet av tørre gasser og forenkle det, får vi:
21 = 1?02 + 02 + 79 . (2-46)
Uttrykke volumet av tørre gasser gjennom volumet av triatomiske gasser Vc. g = = vi omskriver ligningen (2-46) i form av den såkalte ligningen
Komplette forbrenningsforhold:
21 = IOg + Og + pIOg, ($2-47
Der p betyr
T/NaO T/NaO
Substituere i (2-48) i henhold til ligning (2-3) verdien for 1^*°, forutsatt at en del av hydrogenet oksideres på grunn av brennstoffoksygen, og verdien for i henhold til (2-7), uttrykket for p kan representeres gjennom den elementære sammensetningen av drivstoffet i formen:
P = 2,35<2-48а?
Den fysiske betydningen av koeffisienten p (2-48) er at den viser forholdet mellom luftoksygenforbruk for oksidasjon av fritt drivstoffhydrogen (dvs. drivstoffhydrogen, unntatt dens del assosiert med drivstoffoksygen) 0,01 (nr. -0,126 eller) til forbruket av oksygen for dannelse av triatomære gasser.
Basert på den kjente prosentandelen av O2 i forbrenningsprodukter og koeffisienten p, ved hjelp av ligning (2-47), er det mulig å bestemme prosentandelen av triatomære gasser:
Ved 02-0, dvs. ved a-1, når I02-innholdet sin maksimale verdi
VD "a": = t|t. " (2-50!
Hvis de brennbare komponentene i drivstoffet var karbon og svovel, og det ikke var oksygen og hydrogen i det, eller hvis det var så mye hydrogen at det kunne oksideres på grunn av oksygenet i drivstoffet, så ved fullstendig forbrenning av drivstoffet med den teoretisk nødvendige mengden luft, vil innholdet av triatomiske gasser være 21 %, slik som i dette tilfellet i (2-50) i henhold til (2-48a) p = 0.
Fast og flytende brensel inneholder vanligvis mindre oksygen enn det som kreves for fullstendig oksidasjon av hydrogen, derfor vil en del av oksygenet i luften forbrukes for oksidering av fritt hydrogen 0,01 (Hp-0,126 0p) av drivstoffet. Derfor vil I02-innholdet i tørre gasser være mindre enn 21 % og kan bestemmes av (2-49).
Som man kan se av uttrykk (2-48a) og (2-49), er koeffisienten p og verdien av IOg kun avhengig av den elementære kjemiske sammensetningen til drivstoffet og er derfor viktige egenskaper ved drivstoffet. Verdiene av P og I02max for noen drivstoff er gitt i tabellen. 2-3.
|
Koeffisient (3 og verdi 102aKS for noen drivstoff
|
Forbrenning av drivstoff i en motorsylinder er en kompleks kjemisk prosess. Ved å utelate alle mellomstadier av forbrenningsprosessen, vil vi vurdere de endelige kjemiske reaksjonene til elementene som utgjør drivstoffet med oksygen i luften.
Kjemiske reaksjoner under fullstendig forbrenning av flytende drivstoff. Grunnstoffsammensetningen til drivstoff bestemmes av ligning (36).
Ved fullstendig forbrenning av drivstoff antas det at som et resultat av reaksjoner av karbon og hydrogen med atmosfærisk oksygen, dannes henholdsvis karbondioksid og vanndamp. I dette tilfellet tilsvarer oksidasjonen av karbon og hydrogen i drivstoffet de kjemiske ligningene:
Når vi beregner de innledende og endelige reaksjonsproduktene i masseenheter, får vi: for C kg I C I

Når det beregnes i kmol

Fra ligning (40) og (41) er det klart at som et resultat av reaksjonen av karbon med oksygen, er volumet av mol av sluttproduktene av CO2-reaksjonen lik volumet av oksygen som deltar i reaksjonen. Reaksjonene mellom hydrogen og oksygen fører til en dobbel økning i volumet (antall mol) vanndamp sammenlignet med oksygenet som forbrukes.
Bestemmelse av den teoretisk nødvendige luftmengden under fullstendig forbrenning av flytende drivstoff. Den minste mengden oksygen O0 som må tilføres utenfra til drivstoffet for fullstendig oksidasjon, kalles den teoretisk nødvendige mengden oksygen. Fra ligning (38) og (39) følger det at for fullstendig forbrenning av 1 kg drivstoff, trengs følgende mengde oksygen ved beregning:
![]()
eller i henhold til ligning (40) og (41) ved beregning i kmol
![]()
I forbrenningsmotorer er oksygenet som er nødvendig for forbrenningen inneholdt i luften, som føres inn i sylinderen under inntaksprosessen. Tatt i betraktning at oksygen i luften inneholder ca. 23 vekt-% og 21 volum-%, får vi derfor den teoretisk nødvendige mengden luft for forbrenning
1 kg drivstoff i kg:
![]()
eller i kmol
![]()
derfor:
![]()
for forbrenning av den støkiometriske blandingen kan sammensetningen finnes gjennom drivstoffkarakteristikk 6, som bestemmes av formelen
Egenskapene til drivstoff p" under dets forbrenning i atmosfærisk luft avhenger av drivstoffets elementære sammensetning og mengden oksygen i luften.
Etter noen transformasjoner, formel (45) ved beregning
![]()
(i kmol) vil ha formen
er gitt i tabellen. 5.
" mol 02, og som et resultat dannes m/z mol I20. Deretter, tatt i betraktning tilstedeværelsen av oksygen O2 i en gitt gass, uttrykkes oksidasjonsreaksjonen til komponenten ved ligningen

med oksygen basert på formel (49) har formen
vil bli bestemt ut fra uttrykket
Volumfraksjoner av individuelle komponenter i gassformig brensel.
Overskytende luftkoeffisient. I en bilmotor, avhengig av typen blandingsdannelse, forholdene for tenning og forbrenning av drivstoff og driftsmodus, kan mengden luft som faktisk forbrukes være større enn, lik eller mindre enn teoretisk nødvendig for fullstendig forbrenning.
i kmol) til mengden luft som teoretisk kreves for forbrenning av 1 kg drivstoff kalles overskuddskoeffisienten og er betegnet med en:
![]()
(overflødig oksygen), kalles blandingen mager.
på grunn av oksygenmangel
I dieselmotorer der det brukes høykvalitetsregulering, varierer koeffisienten a mye avhengig av belastningen (fra 5 eller mer ved lav belastning til 1.41.25 ved full belastning). I fig. Figur 18 viser koeffisientens avhengighet av motorbelastningen.
xg brukes ofte i analysen av motorens driftsprosess og kalles luft-drivstoff-forholdet.
(fullstendig forbrenning). I en gnisttenningsmotor kommer luft og drivstoff inn i sylinderen som en brennbar blanding under inntaksprosessen. Med fullstendig forbrenning av 1 kg drivstoff, den totale mengden brennbar blanding (i kmol), bestående av drivstoffdamp og luft,
![]()
hvor rt er molekylvekten til drivstoffet (se tabell 5).
I en dieselmotor dannes luft-drivstoffblandingen i forbrenningskammeret under drivstoffinjeksjon på slutten av kompresjonsprosessen og under forbrenningsprosessen. Som et resultat av dette, og også på grunn av det lille volumet som er okkupert, blir ikke drivstoffets molekylmasse tatt i betraktning,
For gassformig drivstoff (i kmol eller m3)
For ethvert drivstoff, blandingsmasse (i kg)

Mengden av individuelle komponenter i forbrenningsprodukter (i kmol) bestemmes av følgende ligninger:

Masse oksygen som deltok i reaksjonen, kmol.
vi får (i kmol)

Etter å ha erstattet uttrykk (58), (60) og (62) i ligning (57), finner vi:
verdien fra uttrykk (45), vil vi ha (i kmol)
La oss bestemme mengden av forbrenningsprodukter (i kmol) gjennom egenskapene til drivstoffet. Fra formlene (58), (59), (61) og (62) har vi
Etter passende transformasjoner får vi
![]()
![]()
mengde forbrenningsprodukter (i kmol)
Følgelig avhenger massen av overflødig nitrogen og oksygen i forbrenningsprodukter av overskuddsluftforholdet.
Masse av forbrenningsprodukter (i kg) under forbrenning av 1 kg flytende drivstoff
La oss bestemme mengden av forbrenningsprodukter under forbrenning av gassformig drivstoff. For 1 mol (eller 1 m3) gassformig drivstoff har vi antall individuelle komponenter (i mol eller m3)

hvor N2 er mengden nitrogen i drivstoffet, mol eller m3.
Når 1 mol eller 1 m3 gassformig brensel forbrennes, vil mengden av forbrenningsprodukter (i mol eller m3)
fra formel (50), da
der Mo er i mol eller m3.
Vurderer
vi får (i mol eller m3)
fra ligning (74) vi har
viser at forholdet mellom antall mol hydrogen og karbonmonoksid er tilnærmet konstant for et gitt drivstoff og ikke er avhengig av verdien av a. La oss betegne dette forholdet med
Den kjemiske reaksjonen av karbon med oksygen under ufullstendig forbrenning har formen
![]()
volumet av forbrenningsprodukter øker 2 ganger sammenlignet med volumet av oksygen som deltok i forbrenningen.
) mengde produkter
Forbrenningsverdi (i kmol)
Mengden vanndamp i forbrenningsprodukter ved ufullstendig forbrenning bestemmes ut fra ligningen
Mengde fritt hydrogen (i kmol) i forbrenningsprodukter
Total mengde vanndamp og hydrogen i forbrenningsprodukter (i kmol)
Tatt i betraktning nitrogenet i luften, den totale mengden av forbrenningsprodukter fra ligningene (82) og (85) (i kmol)
gjennom drivstoffkarakteristikken [Eq.
Mengden oksygen som deltar i reaksjonen som kreves for forbrenning av karbon
![]()
karbon i CO
hydrogen
![]()
Den totale mengden oksygen som er involvert i reaksjonen er
Fra ligningene (82), (85) og (79) har vi

Etter å ha erstattet uttrykk (92) og (93) i ligning (91), får vi
Mengden av hver komponent (i kmol) inkludert i forbrenningsproduktene bestemmes av følgende formler, hentet fra henholdsvis uttrykk (79), (92), (93) og (95):
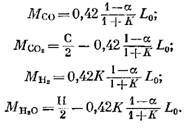
Nitrogenmengde
![]()
Sotpartikler er fast filtrat som hovedsakelig består av fast karbon C.
den termiske effekten av reaksjonen reduseres som følge av dannelsen av CO fra en del av karbonet. Tilstedeværelsen av disse komponentene er ekstremt uønsket, da de har giftige egenskaper. Når disse komponentene fjernes fra motorsylinderen med eksosgasser, forurenser de luften og har en skadelig effekt på menneskers helse. Derfor har det nylig blitt gitt spesiell oppmerksomhet til nøytralisering av eksosgasser som slippes ut i atmosfæren. De giftige komponentene i forbrenningsprodukter inkluderer også blyoksider dannet under forbrenning av blyholdig bensin (se tabell 2).
aldehyder og sot skyldes ufullstendig forbrenning og termisk nedbrytning av hydrokarboner selv når det er overflødig oksygen. Mengden av disse komponentene avhenger av arten av de mellomliggende kjemiske reaksjonene.
Konsentrasjonen er imidlertid relativt lav.
i forbrenningsprodukter er forklart av tilstedeværelsen av nærveggsoner "i forbrenningskammeret, hvor på grunn av ladningens kontakt med veggene, som har relativt lave temperaturer, flammen slukkes.
Aldehyder produseres i perioden da oksidasjonsprosessen skjer ved lave temperaturer. Dette fenomenet observeres under oppstart, så vel som under driftsmoduser i de områdene hvor den brennende blandingen avkjøles av relativt kalde overflater som begrenser forbrenningskammeret. I en dieselmotor, hvor drivstoffinnsprøytning starter rett før forbrenningen starter, dannes aldehyder under såkalte forflammereaksjoner som oppstår under klargjøring av luft-drivstoffblandingen for forbrenning (se kapittel VI). Driften av en dieselmotor med en veldig mager blanding, som er typisk for lav belastning, samt forbrenning av den siste delen av drivstoff i bensinmotorer, når en spesiell metode for å organisere forbrenningsprosessen (lag-for-lag-blanding) formasjon) brukes, fører til dannelse av aldehyder.
i forskjellige områder av kammeret
Sammen med forbrenningen brytes drivstoffet ned og karbon (sot) frigjøres. I forgassermotorer er sammensetningen av blandingen homogen (homogen), og sot dannes i nesten ubetydelige mengder under normal motordrift.
Nitrogenoksider produseres i nærvær av atomært oksygen i de områdene av forbrenningskammeret der temperaturen stiger kraftig som et resultat av den kjemiske reaksjonen av oksidasjon av drivstoffhydrokarboner. Mengden nitrogenoksid som dannes avhenger av nitrogen- og oksygeninnholdet i forbrenningsproduktene.
bestemmes av betingelsene for utvekslingsdiffusjon av forbrenningsprodukter med atmosfærisk luft.
i forbrenningsprodukter når gnisttenningsmotoren går uten belastning og tomgang (GOST 1653370) og på røykinnholdet i dieseleksosgasser (GOST 1902573).
Sammensetning av forbrenningsprodukter. Avhengig av hvilke krav som stilles ved fastsettelse av sammensetningen av forbrenningsprodukter, velges passende utstyr og analyseteknikk. Spesiell litteratur er viet utstyret og metodene for å analysere gassprøver.
I fig. Figur 19 viser kurver for innholdet av forbrenningsprodukter i eksosgassene til en dieselmotor og en forgassermotor avhengig av a. Endringen i koeffisient a avhenger av motorbelastningen.
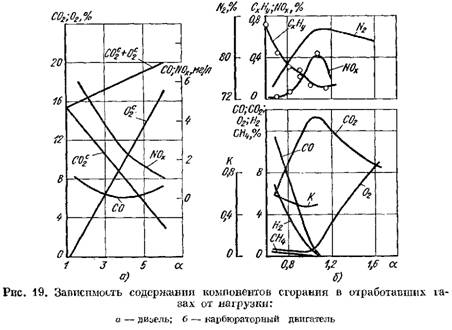
når det gjelder tørrvekt (fig. 19, a)
øker.
2 øker kraftig og forbrenningsproduktene inneholder en liten mengde oksygen som ikke deltok i forbrenningen.
![]() når forbrenningsprosessen forverres.
når forbrenningsprosessen forverres.
Brennbare brenselstoffer interagerer med luftoksygen i et visst kvantitativt forhold. Luftforbruk for forbrenning og mengden drivstoffforbrenningsprodukter beregnes ved hjelp av støkiometriske forbrenningsligninger, som er skrevet for 1 km for hver brennbar komponent.
Teoretisk og faktisk forbrenningsluftforbruk og mengden drivstoffforbrenningsprodukter. De støkiometriske ligningene for forbrenning av brennbare komponenter av fast og flytende brensel har formen:
karbon C + O 2 = CO 2:
12 kg C + 32 kg O 2 = 44 KG CO 2;
1 kg C + (32: 12) kg O 2 = (44: 12) kg CO 2 (18,21)
svovel S + O 2 = SO 2:
32 kg S + 32 kg O2 = 64 kg S02;
1 kg S + 1 kg O2 = 2 kg S02; (18.22)
hydrogen 2H 2 + O 2 = 2H 2 O:
4 kg H2 + 32 kg O2 = 36 kg H20;
1 kg H 2 + 8 kg O 2 = 9 kg H 2 (18,23)
Drivstoffet inneholder C p /100 kg karbon, Sp / l 100 kg flyktig svovel, H p /100 kg hydrogen og O p /100 kg oksygen. Følgelig vil det totale forbruket av oksygen som kreves for forbrenning av 1 kg drivstoff, i henhold til de støkiometriske ligningene, være lik:
Massefraksjonen av oksygen i luft er 0,232. Deretter bestemmes massemengden luft fra formelen:

Under normale forhold er lufttetthet p0 = 1,293 kg/m3.
Forbrenningsluftforbruk og mengden drivstoffforbrenningsprodukter kan enkelt beregnes som:
V 0 = M 0 /1,293 m 3 luft/kg drivstoff (18,26)
Dermed,
V 0 = 0,0889 (Cp + 0,375S p/l) + 0,265H p - 0,033O p (18,27)
For gassformig drivstoff bestemmes forbruket V0 basert på volumfraksjonene av brennbare komponenter inkludert i gassen ved bruk av støkiometriske reaksjoner:
H2 + 0,502 = H20;
CO + 0,502 = CO2;
CH4 + 202 = CO2 + 2H20;
H 2 S + 1,5 O 2 = SO 2 + H 2 O. (18,28)
Den teoretiske mengden luft, m 3 / m 3, som kreves for gassforbrenning, bestemmes av formelen:

Volumkonsentrasjonen av komponentene, %, erstattes med ligning (18.29). Hvis det ikke finnes data om konsentrasjonen av umettede hydrokarboner, anses de å bestå av C 2 H 4.
Mengden luft V n, beregnet ved hjelp av de støkiometriske ligningene (18.27) og (18.29), kalles teoretisk nødvendig, dvs. verdien V 0 er minimumsmengden luft som kreves for å sikre fullstendig forbrenning av 1 kg (1 m 3) av drivstoff, forutsatt at alt oksygenet i det og oksygenet i drivstoffet vil bli brukt under forbrenningen.
På grunn av visse vanskeligheter med å organisere prosessen med fullstendig blanding av brensel med luft i arbeidsvolumet til ovnene, kan det oppstå områder hvor en lokal mangel eller overskudd av oksidasjonsmiddel vil merkes. Som et resultat forringes kvaliteten og forbruket av forbrenningsluft og mengden av drivstoffforbrenningsprodukter. Derfor, under reelle forhold, tilføres luft til drivstoffforbrenning i større mengder sammenlignet med dens teoretiske mengde V 0 . Forholdet mellom den faktiske mengden luft som tilføres brennkammeret og den teoretisk nødvendige kalles overskuddskoeffisienten:
α = V d /V 0.(18.30)
Ved utforming og termisk beregning av ovner eller andre forbrenningskamre, velges verdien av a avhengig av typen brennstoff som forbrennes, forbrenningsmetoden og utformingen av forbrenningskamrene. a-verdien varierer fra 1,02 til 1,5.
Sammensetning og mengde produkter fra fullstendig forbrenning av drivstoff. Produktene av fullstendig forbrenning av drivstoff ved α = 1 inneholder: tørre (ikke-kondenserende i kjeleenheten) triatomiske gasser CO 2 og SO 2;
H 2 O - vanndamp oppnådd fra forbrenning av hydrogen; N 2 - drivstoffnitrogen og nitrogen inneholdt i den teoretisk nødvendige luftmengden.
I tillegg inkluderer forbrenningsproduktene vanndamp som følge av fordampning av drivstofffuktighet, damp innført i ovnen med fuktig luft, og damp som noen ganger brukes ved brenning av fyringsolje for forstøvning. Når temperaturen på forbrenningsproduktene er under duggpunkttemperaturen, kondenserer vanndamp. Ved fullstendig forbrenning med α = 1 vil forbrenningsproduktene kun inneholde CO 2, SO 2, H 2 O og N 2; hvis α > 1, vil de også inneholde overskudd av luft, dvs. ytterligere mengder oksygen og nitrogen.
Prosentandelen av de tilsvarende gassene i volum vil bli betegnet med CO 2, N 2, SO 2, etc., og med V co2, V so2, V n2, etc. - volumet deres oppnådd ved å brenne 1 kg (1 m3) drivstoff, redusert til normale forhold (indeks 0 indikerer at beregninger er gjort ved α = 1). Da får vi:
CO 2 + SO 2 + N 0 / 2 + H 2 O 2 = 100 %
V 0 / r = V co2 + V S2O + V 0 / N2 + V 0 H2O (18.31)
Der V o / r er det totale volumet av forbrenningsprodukter, redusert til normale forhold, m 3 / kg.
For å forenkle beregninger beregnes volumene av tørre triatomiske gasser sammen og summen deres er konvensjonelt betegnet med symbolet RO 2, dvs.
V ro2 = V co2 + V so2 (18,32)
Summen av de tre første komponentene i likhet (18.31) representerer volumet av tørre gasser V с.p og derfor,
V o r = V o c.g + V 0 H2O (18.33)
hvor V 0 c.r = V ro2 + V 0 N2
Mengdene V 0 N2, V 0 H2O, V 0 c.r, V 0 og V ro2 er de teoretiske volumene av gasser ved forbrenning av 1 kg fast eller flytende brensel triatomiske gasser er lik:
Tetthetene av karbondioksid og svoveldioksid, redusert til normale forhold, er henholdsvis lik p co2 = 1,964 kg/m 3 og P so2 = 2,86 kg/m 3. Deretter kan volumet av triatomiske gasser V RO2 bestemmes av formelen:

Det teoretiske volumet av vanndamp som dannes ved forbrenning av hydrogen V r H2O bestemmes i henhold til ligning (18.23). Til dette volumet er det nødvendig å legge til volumet av damp som dannes under fordampning av drivstofffuktighet V r H2O. volumet av dysedamp V f H2O og volumet vanndamp inneholdt i luften V i H2O, da: 
hvor 0,805 er tettheten av vanndamp under normale fysiske forhold, kg/m 3 ; W f - dyse dampforbruk (antatt W f = 0,3 ÷ 0,35 kg/kg),
Det totale teoretiske volumet av vanndamp bestemmes av formelen:
V 0 H 2 O = 0,111 H p + 0,0124 W p + 1,24 W f + 0,0161 V 0 (18,41)
Det teoretiske volumet nitrogen (1 m3 per 1 kg drivstoff) ved α = 1 består av luftnitrogen og brenselsnitrogen, dvs.
hvor p N2 = 1,25 - nitrogentetthet, kg/m 3.
Når luftoverskuddskoeffisienten α > 1, vil sammensetningen av forbrenningsproduktene i tillegg inkludere overskuddsluft og vanndamp innført med denne luften. Volumer av forbrenningsprodukter kl
α = 1 kalles reelle volumer.
Faktiske volumer vil være:

Verdien av V RO2 avhenger ikke av verdien av overskuddskoeffisienten.
Teoretiske volumer av forbrenningsprodukter på 1 m 3 gassformig brensel er beregnet basert på støkiometriske reaksjoner (18.28). Ved fullstendig forbrenning av de brennbare komponentene i gassformig brensel CO, H 2 og C m H n, dannes karbondioksid CO 2 og vanndamp. Når hydrogensulfid H 2 S brennes, dannes det i tillegg til vanndamp svoveldioksid SO 2.
Volum av triatomiske gasser, m 3 / m 3,

hvor a er fuktighetsinnholdet i gassen, g/m3.
Volumet av nitrogen, tørre gasser og det totale volumet av forbrenningsprodukter, samt for flytende og fast brensel, bestemmes ved hjelp av formlene (18.42), (18.33) og (18.31).
For α > 1 er det faktiske volumet av vanndamp, tørrgass og det totale volumet av forbrenningsprodukter funnet ved hjelp av formlene (18.43), (18.45) og (18.46). Hvis sammensetningen av umettede hydrokarboner CnH2n inkludert i gassen er ukjent, og deres totale innhold ikke overstiger 3%, blir de tatt i betraktning som C2H4 i beregningen.
Forbrenningsberegninger basert på gassanalyseresultater. Gassanalyse av forbrenningsprodukter er ment å kontrollere kvaliteten (fullstendigheten) av drivstoffforbrenningen. For dette formålet brukes kjemiske gassanalysatorer som VTI og GPC - 3. Prinsippet for deres drift er basert på selektiv absorpsjon av komponenter som er inkludert i forbrenningsprodukter av kjemiske reagenser som fyller absorpsjonskolonnene til gassanalysatoren. For å absorbere RO 2 brukes en KOH-løsning, og for å absorbere O 2 brukes en alkalisk løsning av pyrogallol C 6 H 3 (OH) 3.
For tiden er kromatografisk gassanalyse mye brukt, basert på fysiske metoder for å separere gassblandinger i deres bestanddeler. Prinsippet for drift av kromatografen er basert på forskjellen i adsorpsjonsegenskapene til forskjellige gasser når de passerer gjennom et lag av sorbent (silikagel).
Beregninger basert på resultatene av gassanalyse gjøres for volumet av tørre gasser.
Bestemmelse av karbonmonoksid under forbrenning av fast og flytende brensel. Når drivstoffet forbrennes ufullstendig, inneholder forbrenningsproduktene alltid en viss mengde karbonmonoksid CO. Ligningen for sammensetningen av tørre forbrenningsprodukter har formen
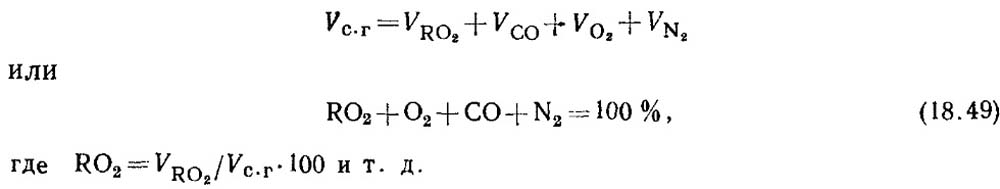
Basert på resultatene av gassanalysen bestemmes prosentandelen av RO 2 og O 2 i forbrenningsprodukter.
Bestemmelse av CO ved bruk av absorpsjonsmetoden er uønsket på grunn av metodens ganske store feil. Derfor bestemmes CO-innholdet i gasser ved beregning.
Ved fullstendig forbrenning av rent karbon og α = 1 inneholder forbrenningsproduktene CO 2 og N 2, med COmax2 = RO max2 = 21%. I tillegg til karbon inneholder den brennbare massen av fossilt brensel alltid en viss mengde hydrogen. Derfor er konsentrasjonen av RO max 2 i tørre forbrenningsprodukter alltid mindre enn 21 %, dvs. med en reduksjon i karbon- og svovelinnholdet i drivstoffet, reduseres også verdien av RO max 2. Det er en viss dimensjonsløs mengde som kan brukes til å fastslå forholdet mellom grunnstoffsammensetningen til drivstoffet og innholdet av tre atomgasser i de tørre forbrenningsproduktene. Denne verdien kalles drivstoffkarakteristikken, og er betegnet med bokstaven β.

Verdiene av RO max 2 og β for hver type drivstoff med en viss sammensetning er konstante (tabell 18.4).
Tabell 18.4. RO max 2 OG β-verdier for noen drivstoff.

Når luftoverskuddskoeffisienten β øker over enhet, vil fritt oksygen og RO 2 vises i de tørre produktene ved fullstendig forbrenning som et resultat av overflødig luft< RO мак с 2 . При известном значении α содержание RО 2 можно приближенно определять по эмпирической формуле:
RO 2 = RO maks 2 / α (18,52)
I den spesialiserte litteraturen er den såkalte ligningen for fullstendig forbrenning av drivstoff utledet:
RO 2 + O 2 = 21 β RO 2. (18.53)
Hvis høyre og venstre side av ligning (18.53) ikke er lik hverandre, er det ingen fullstendig forbrenning, og i dette tilfellet kalles forskjellen (21 - βPRO 2 l) - (RO 2 + O 2) = z egenskapen til ufullstendig forbrenning av drivstoffet.
Ligningen for ufullstendig forbrenning av drivstoff er skrevet i følgende form:
21 - β RO 2 = RO 2 + O 2 + (0,605 + β) CO.(18,53")
Ved bruk av den kromatografiske metoden for gassanalyse er det ikke nødvendig å beregne CO med formel (18.54), siden karbonmonoksidinnholdet kan bestemmes direkte på kromatografen.
Luftforbruk til forbrenning og mengden drivstoffforbrenningsprodukter ved ufullstendig forbrenning. Volumet av tørre forbrenningsprodukter bestemmes fra resultatene av gassanalyse i henhold til ligning (18.49) som følger. Prosentandel av RO 2 i gasser:

Bestemmelse av brennbare CO-bestanddeler CO, CH 4 og H 2 ved ufullstendig forbrenning av gassformig brensel. Sammensetningsligningen for tørre forbrenningsprodukter kan skrives som følger:
Ved hjelp av den kromatografiske metoden for gassanalyse er det mulig å bestemme alle komponentene i den brennbare delen av forbrenningsproduktene CO, CH 4 og H 2.
Hvis resultatene av analysen bare er kjent for RO 2 og O 2, for å bestemme CO i gasser, tas verdien av drivstoffkarakteristikken β i henhold til referansedata eller, hvis sammensetningen av den opprinnelige brennbare gassen er kjent, β bestemmes ved beregning med obligatorisk hensyn til CO t 2 -innholdet i gassen:
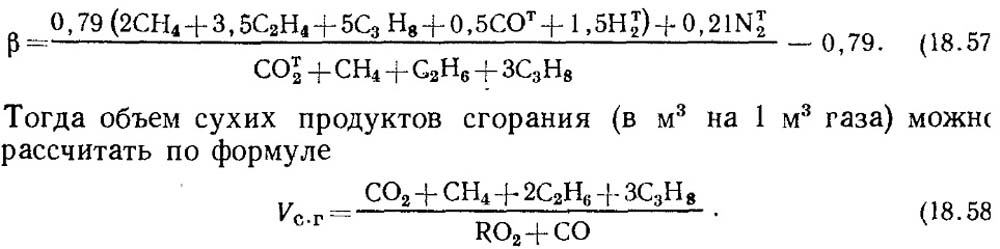
Det skal bemerkes at for kunstige gasser som inneholder en stor mengde CO t 2, kan drivstoffkarakteristikken β være negativ.
Bestemmelse av overskuddskoeffisient. Overskuddskoeffisienten bestemmes fra gassanalysedata for tørre forbrenningsprodukter. For fullstendig forbrenning, når det ikke er brennbare komponenter CO, CH 4, H 2 i forbrenningsproduktene

Ved ufullstendig forbrenning

Med fullstendig forbrenning av drivstoff og en kjent verdi på RO max 2, kan formel (18.52) brukes for bestemmelse.
Eksempel. Bestem lavere og høyere forbrenningsvarme for naturlig Saratov (Elshan) gass med følgende volumetriske sammensetning, %: CH 4 - 94, C 2 H 6 - 1,8, C 3 H 8 - 0,4, C 4 H 10 - 0, 1 , C5H12 - 0,1,
CO2 - 0,1, N2 - 3,5.
Løsning: 1. Den laveste brennverdien, kJ/m 3, er: metan CH 4 - 35,8 × 10 3, etan C 2 H 4 - 64,6 × 10 3, propan C 3 H 8 - 91,5 × 10 3, butan C 4 H 10 - 119,0 x 10 3, pentan C 5 H 12 - 146,5 x 10 3.
Ved hjelp av formel (18.6) bestemmer vi
Q c n = (35,8×94 + 64,6×1,8 + 91,5×0,4+ 119×0,1 + 146,5×0,1) 103×0,01 = 35 300 kJ/m 3.
Den høyeste brennverdien, kJ/m 3, er: metan CH 4 - 39,8 × 10 3, etan C 2 H 4 - 70 × 10 3, propan C 3 H 8 - 99,5 × 10 3, butan C 4 H 10 - 28,5 × 103, pentan C8H12 - 157,5 × 103.
Ved hjelp av formel (18.17) finner vi
Q с в = (39,8 × 94 + 70 × 1,8 + 99,5 × 0,4 + 128,5 × 0,1 +157,5 × 0,01) 103 × 0,01 = 39 300 kJ/m3.




