Forbrenning er kjemisk prosess kombinasjon av et brennbart stoff med et oksidasjonsmiddel, ledsaget av intens varmeutgivelse og lysutslipp.
Betingelsen for at forbrenning skal oppstå er at hastigheten for varmeavgivelse ved en kjemisk reaksjon overstiger hastigheten for varmefjerning i miljø. Hvis denne betingelsen er oppfylt, oppstår selvoppvarming brennbar blanding og reaksjonshastigheten øker. Omvendt fører et overskudd av varmefjerningshastigheten i forhold til frigjøringshastigheten til demping av forbrenningsprosessen.
Det finnes flere typer forbrenning:
Et blits er rask forbrenning av en brennbar blanding uten at det dannes økt gasstrykk.
Brann - forekomsten av forbrenning fra en antennelseskilde.
Tenning er en brann ledsaget av utseendet til en flamme.
Spontan forbrenning er en forbrenning som skjer i fravær av en ekstern tennkilde.
Spontan forbrenning er spontan forbrenning ledsaget av utseendet til en flamme.
En eksplosjon er en ekstremt rask forbrenning der energi frigjøres og det dannes komprimerte gasser som kan forårsake mekanisk ødeleggelse.
Forbrenningen av gasser skjer i diffusjonen (når oksygen trenger inn i forbrenningssonen) og kinetisk (homogen brennbar blanding) regionen og kan ha karakter av eksplosiv eller detonasjonsforbrenning (høy hastighet på flammebevegelse).
Når en væske brenner, fordamper den og damp-luftblandingen brenner over overflaten av væsken. Den avgjørende faktoren er prosessen med væskefordampning, som avhenger av dens Fysiske og kjemiske egenskaper, den termiske prosessen i den, etc. Forbrenningsprosessen av damper er ikke forskjellig fra forbrenning av gasser.
Forbrenning av faste stoffer er heterogen diffusjon (det vil si forbrenning i forskjellige faser med penetrering - smelting, dekomponering og fordampning med frigjøring av gassformige produkter som danner en brennbar blanding med luft).
Støv har økt brannfare. Dessuten, med økende spredning (dette er i hovedsak metning, forholdet mellom overflatearealet til partikler og volumet de opptar) av støv, øker dens kjemiske aktivitet, selvantennelsestemperaturen reduseres, noe som øker brannfaren. Brennhastigheten til høyt spredt støv nærmer seg brennhastigheten til gass. Ikke bare suspendert støv, men også avsatt støv er eksplosivt, siden det ved tenning blir suspendert, noe som fører til sekundære eksplosjoner.
Avhengig av hastighet kjemisk reaksjon og dannelsen av en brennbar blanding, kan forbrenning skje i form av:
· ulming - hastighet opptil flere cm/s;
· selvforbrenning - hastighet opptil flere m/s;
· eksplosjon - hastighet flere hundre m/s;
· detonasjon - hastighet opptil flere tusen m/s
Forbrenningsreaksjoner inkluderer ikke bare interaksjonsreaksjonene mellom brennbare stoffer og oksygen, men også andre redoksreaksjoner: interaksjonen mellom visse stoffer med halogener, svoveldamp, spaltningsreaksjoner av eksplosiver og noen endoterme forbindelser, for eksempel acetylen.
H 2 + Cl 2 = 2 HCl + Q
C 3 H 5 (NO 3) 3 = 3CO 2 + 2,5 H 2 O + 1,5 N 2 + 0,25 O2
C2H2 = 2C + H2 + Q
Klasser av branner etter type forbrenningsmaterialer. For å lykkes med å slukke en brann, er det nødvendig å bruke de mest effektive brannslukningsmidlene, hvis valg må avgjøres nesten umiddelbart.
Riktig valg brannslukningsmiddel vil sikre rask opphør av forbrenningen.
Denne oppgaven er sterkt forenklet på grunn av innføringen av brannklassifisering. Den internasjonale standardiseringsorganisasjonen introduserer 5 klasser av branner (Standard 3941-77):
Klasse A: harde materialer
Klasse B: Brannfarlige væsker
Klasse C: Forbrenning av gasser, inkl. flytende
Klasse D: Alkalimetaller (natrium, litium, kalsium, etc.)
Klasse E: Strømførende elektriske apparater og ledninger.
Klasse "A" branner - forbrenning av faste brennbare materialer. Slike materialer inkluderer tre og produkter laget av det, stoffer, papir, gummi, noe plast og andre.
Disse materialene slukkes hovedsakelig med vann, vandige løsninger og skum.
Branner i klasse "B" - forbrenning av flytende stoffer, deres blandinger og forbindelser. Denne klassen av stoffer inkluderer olje og flytende petroleumsprodukter, fett, maling, løsemidler og andre brennbare væsker.
Slukking av slike branner utføres hovedsakelig ved hjelp av skum ved å dekke det med et lag av overflaten av en brennbar væske, og dermed skille den fra forbrenningssonen og oksidasjonsmidlet. I tillegg kan klasse "B" branner slukkes med sprøytet vann, pulver og karbondioksid.
Klasse "C" branner - forbrenning gassformige stoffer og materialer. Denne klassen av stoffer inkluderer brennbare gasser som brukes på sjøfartøyer som teknologisk forsyning, samt brannfarlige gasser som transporteres med sjøfartøyer som last (metan, hydrogen, ammoniakk osv.). Slukking av brannfarlige gasser utføres med kompakte vannstråler eller ved bruk av brannslukningspulver.
Klasse "D" branner er branner som involverer alkali og lignende metaller og deres forbindelser i kontakt med vann. Slike stoffer inkluderer natrium, kalium, magnesium, titan, aluminium osv. Varmeabsorberende midler brukes til å slukke slike branner. brannslukningsmidler, for eksempel noen pulvere som ikke reagerer med brennende materialer.
Klasse "E" branner er forbrenning som oppstår når strømførende elektrisk utstyr, ledere eller elektriske installasjoner antennes. For å bekjempe slike branner brukes brannslukningsmidler som ikke er strømledere.
Typer forbrenning, deres egenskaper.
| Parameternavn | Betydning |
| Artikkel emne: | Typer forbrenning, deres egenskaper. |
| Rubrikk (tematisk kategori) | Produksjon |
Brann- ϶ᴛᴏ ukontrollert forbrenning utenfor en spesiell peis, forårsaker materielle skader og utgjør en fare for menneskeliv.
Typer forbrenning:
1) I henhold til hastigheten på flammeutbredelsen, skilles forbrenningen ut: 1. Normal (utbredelseshastighet på flere m/s); 2. Eksplosiv (hastighet hundrevis av m/s); 3. Detonasjon (hastighet på tusenvis av m/s)
2) Ta hensyn til avhengigheten av den samlede tilstanden til brennbare stoffer: homogen og heterogen.
Hvis komponentene i den brennbare blandingen er forhåndsblandet, oppstår kinetisk forbrenning, som bestemmes av hastigheten på den kjemiske reaksjonen. Hvis komponentene ikke blandes, oppstår diffusjonsforbrenning, som bestemmes av diffusjonen av oksygen til det brennbare stoffet gjennom forbrenningsproduktene. Laminær forbrenning kjennetegnes ved lag-for-lag forplantning av flammefronten gjennom en fersk brennbar blanding. Turbulent forbrenning er preget av blanding av lag og økt utbrenningshastighet.
3) I henhold til forbrenningsmodusen: 1. Spontan antennelse - den spontane forekomsten av flammende forbrenning av en brennbar blanding forvarmet til koketemperaturen, som vanligvis kalles selvantennelsestemperaturen (); 2. Forplantning av flammefronten gjennom en fersk brennbar blanding når den er lokalt antent av en ekstern kilde. Spontane forbrenningsprosesser er delt inn i følgende typer:
Termisk som et resultat av langvarig virkning av en varmekilde;
Mikrobiologisk oppstår som et resultat av økt temperatur og fuktighet på grunn av den vitale aktiviteten til organismer (sagflis, korn, torv);
En kjemisk reaksjon oppstår når stoffer interagerer med hverandre eller med oksygen.
I henhold til den andre modusen skilles følgende typer forbrenning:
- Blits– rask forbrenning av en gass-damp-luftblanding over overflaten av et kondensert stoff, ledsaget av en kortvarig synlig glød uten dannelse av økt gasstrykk. Karakterisert av flammepunkt. Flammepunkt er den laveste temperaturen der damper og gasser dannes over overflaten av et kondensert stoff som kan blusse opp i luften fra en tennkilde.
- Brann– forekomsten av forbrenning fra tennkilden;
- Tenning– flammende forbrenning av et stoff som fortsetter etter at tennkilden er fjernet. Karakterisert av antennelsestemperatur. Antennelsestemperatur er den laveste temperaturen der stabil flammeforbrenning skjer over overflaten av det kondenserte stoffet.
- Eksplosjon– ekstremt rask forbrenning hvor energi frigjøres og det dannes komprimerte gasser som kan forårsake mekanisk ødeleggelse. Karakterisert av maksimalt eksplosjonstrykk.
Forbrenningen skal være: 1. Komplett – med overskudd av oksygen. Forbrenningsprodukter er vanndamp og karbondioksid. 2. Ufullstendig - det er ikke nok oksidasjonsmiddel, og karbonmonoksid dannes.
Farlige brannfaktorer inkluderer: - åpen ild, - gnister, - økt lufttemperatur, - giftige forbrenningsprodukter, - redusert oksygenkonsentrasjon.
Typer forbrenning, deres egenskaper. - konsept og typer. Klassifisering og funksjoner i kategorien "Typer forbrenning, deres egenskaper." 2014, 2015.
Emne 4. TYPER FOR FORBRENNING.
I henhold til ulike egenskaper og egenskaper kan forbrenningsprosesser deles inn i følgende typer:
I henhold til aggregeringstilstanden til et brennbart stoff:
Forbrenning av gasser;
Forbrenning av væsker og smeltende faste stoffer;
Forbrenning av ikke-smeltende fast støvlignende og kompakte stoffer.
I henhold til fasesammensetningen av komponentene:
Heterogen forbrenning;
Forbrenning av eksplosiver.
I henhold til beredskapen til den brennbare blandingen:
Diffusjonsforbrenning (brann);
Kinetisk forbrenning (eksplosjon).
I henhold til dynamikken til flammefronten:
Stasjonære;
Ustødig.
I henhold til arten av gassbevegelse:
Laminær;
Turbulent.
I henhold til graden av forbrenning av det brennbare stoffet:
Ufullstendig.
I henhold til flammespredningshastigheten:
Normal;
Deflagrasjon;
Detonasjon.
La oss se nærmere på disse typene.
4.1. Forbrenning av gassformige, flytende og faste stoffer.
Avhengig av aggregeringstilstanden til det brennbare stoffet, skilles forbrenning av gasser, væsker, støvete og kompakte faste stoffer.
I følge GOST 12.1.044-89:
1. Gasser er stoffer kritisk temperatur som er mindre enn 50 o C. Tcr er minimumsoppvarmingstemperaturen på 1 mol av et stoff i et lukket kar, hvor det fullstendig blir til damp (se § 2.3).
2. Væsker er stoffer med et smeltepunkt (dråpepunkt) under 50 o C (se § 2.5).
3. Faste stoffer er stoffer med et smeltepunkt (dråpepunkt) over 50 0 C.
4. Støv er knuste faste stoffer med en partikkelstørrelse på mindre enn 0,85 mm.
Sonen der en kjemisk reaksjon skjer i en brennbar blanding, dvs. forbrenning kalles en flammefront.
La oss vurdere forbrenningsprosesser i luftmiljø med eksempler.
Forbrenning av gasser i en gassbrenner. Det er 3 flammesoner observert her (fig. 12):
Ris. 12. Plan for gassforbrenning: 1 – gjennomsiktig kjegle – dette er den første gassen som varmes opp (til selvantennelsestemperaturen); 2 - lysende sone på flammefronten; 3 – forbrenningsprodukter (de er nesten usynlige under fullstendig forbrenning av gasser og, spesielt under forbrenning av hydrogen, når det ikke dannes sot).
Bredden på flammefronten i gassblandinger er titalls brøkdeler av en millimeter.
Forbrenning av væsker i åpen beholder. Ved brenning i åpent kar er det 4 soner (fig. 13):

Ris. 13. Væskeforbrenning: 1 – væske; 2 - flytende damp (mørke områder); 3 - flammefront; 4 – forbrenningsprodukter (røyk).
Bredden på flammefronten er i dette tilfellet større, dvs. reaksjonen går langsommere.
Forbrenning av smeltende faste stoffer. Vurder brenning av et stearinlys. I i dette tilfellet 6 soner er observert (fig. 14):

Ris. 14. Lysbrenning: 1 – hard voks; 2 - smeltet (flytende) voks; 3 - mørkt gjennomsiktig damplag; 4 - flammefront; 5 - forbrenningsprodukter (røyk); 6 – veke.
Den brennende veken tjener til å stabilisere forbrenningen. Væske absorberes i den, stiger gjennom den, fordamper og brenner. Bredden på flammefronten øker, noe som øker lysstyrkeområdet, siden det brukes mer komplekse hydrokarboner, som når de fordampes, desintegrerer og deretter reagerer.
Forbrenning av ikke-smeltende faste stoffer. Vi vil vurdere denne typen forbrenning ved å bruke eksemplet med forbrenning av en fyrstikk og en sigarett (fig. 15 og 16).
Det er også 5 seksjoner her:
Ris. 15. Brenne en fyrstikk: 1 – fersk ved; 2 - forkullet tre; 3 - gasser (forgassede eller fordampede flyktige stoffer) - dette er en mørk gjennomsiktig sone; 4 - flammefront; 5 – forbrenningsprodukter (røyk).
Det kan sees at det brente området av fyrstikken er mye tynnere og har en svart farge. Det betyr at en del av kampen har blitt forkullet, d.v.s. den ikke-flyktige delen ble igjen, og den flyktige delen fordampet og brant. Forbrenningshastigheten til kull er mye langsommere enn for gasser, så det har ikke tid til å brenne helt ut.
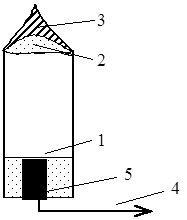
Fig. 16. Sigarettbrenning: 1 – første tobakksblanding; 2 - ulmende seksjon uten flammefront; 3 – røyk, dvs. produkt av brente partikler; 4 - røyk trukket inn i lungene, som hovedsakelig er gassifiserte produkter; 5 – harpiks kondensert på filteret.
Den flammeløse termisk-oksidative nedbrytningen av et stoff kalles ulming. Det oppstår når det er utilstrekkelig diffusjon av oksygen inn i forbrenningssonen og kan oppstå selv med en svært liten mengde oksygen (1-2%). Røyken er grå, ikke svart. Dette betyr at det er mer gassifiserte enn brente stoffer i den.
Askens overflate er nesten hvit. Dette betyr at med tilstrekkelig tilførsel av oksygen oppstår fullstendig forbrenning. Men inni og ved grensen til det brennende laget med friske er det et svart stoff. Dette indikerer ufullstendig forbrenning av forkullede partikler. Forresten, damper av fordampede harpiksholdige stoffer kondenserer på filteret.
En lignende type forbrenning observeres ved brenning av koks, dvs. kull som flyktige stoffer (gasser, harpiks) er fjernet fra, eller grafitt.
Dermed skjer forbrenningsprosessen av gasser, væsker og de fleste faste stoffer i gassform og er ledsaget av en flamme. Noen faste stoffer, inkludert de med tendens til selvantennelse, brenner i form av ulming på overflaten og inne i materialet.
Forbrenning av støvete stoffer. Forbrenningen av et lag med støv skjer på samme måte som i en kompakt tilstand, bare brennhastigheten øker på grunn av en økning i overflaten av kontakt med luft.
Forbrenning av støvete stoffer i form av en luftsuspensjon (støvsky) kan skje i form av gnister, d.v.s. forbrenning av individuelle partikler, ved lavt innhold av flyktige stoffer som ikke er i stand til å danne en tilstrekkelig mengde gasser under fordampning for en enkelt flammefront.
Hvis det dannes en tilstrekkelig mengde forgassede flyktige stoffer, oppstår det flammende forbrenning.
Forbrenning av eksplosiver. TIL denne arten Dette inkluderer forbrenning av eksplosiver og krutt, de såkalte kondenserte stoffene, som allerede inneholder kjemisk eller mekanisk bundet drivstoff og oksidasjonsmiddel. For eksempel: i trinitrotoluen (TNT) C 7 H 5 O 6 N 3 × C 7 H 5 × 3NO 2 er oksidasjonsmidlene O 2 og NO 2; krutt inneholder svovel, salpeter, kull; Det hjemmelagde sprengstoffet består av aluminiumspulver og ammoniumnitrat, og bindemidlet er sololje.
4.2. Homogen og heterogen forbrenning.
Basert på de vurderte eksemplene, avhengig av aggregeringstilstanden til blandingen av drivstoff og oksidasjonsmiddel, dvs. avhengig av antall faser i blandingen, er det:
1. Homogen forbrenning gasser og damper av brennbare stoffer i et gassformig oksidasjonsmiddelmiljø. Dermed skjer forbrenningsreaksjonen i et system som består av én fase (aggregattilstand).
2. Heterogen forbrenning faste brannfarlige stoffer i et gassformig oksidasjonsmiddelmiljø. I dette tilfellet skjer reaksjonen ved grensesnittet, mens en homogen reaksjon skjer i hele volumet.
Dette er forbrenning av metaller, grafitt, dvs. praktisk talt ikke-flyktige materialer. Mange gassreaksjoner har en homogen-heterogen natur, når muligheten for at en homogen reaksjon oppstår skyldes opprinnelsen til en samtidig heterogen reaksjon.
Forbrenningen av alle flytende og mange faste stoffer, hvorfra damper eller gasser (flyktige stoffer) frigjøres, skjer i gassfasen. Faste og flytende faser spiller rollen som reservoarer av reagerende produkter.
For eksempel går den heterogene reaksjonen av spontan forbrenning av kull inn i den homogene fasen av forbrenning av flyktige stoffer. Koksresten brenner heterogent.
4.3. Diffusjon og kinetisk forbrenning.
Basert på graden av tilberedning av den brennbare blandingen, skilles diffusjon og kinetisk forbrenning.
Forbrenningstypene som vurderes (unntatt eksplosiver) gjelder diffusjonsforbrenning. Flamme, dvs. Forbrenningssonen til en blanding av drivstoff og luft må hele tiden tilføres drivstoff og oksygen for å sikre stabilitet. Tilførselen av brennbar gass avhenger bare av hastigheten på tilførselen til forbrenningssonen. Inntrengningshastigheten for brennbar væske avhenger av intensiteten av dens fordampning, dvs. på damptrykket over overflaten av væsken, og følgelig på væskens temperatur. Antennelsestemperatur er den laveste temperaturen til en væske der flammen over overflaten ikke vil slukke.
Forbrenning av faste stoffer skiller seg fra forbrenning av gasser ved tilstedeværelsen av et trinn med nedbrytning og gassifisering med påfølgende antennelse av flyktige pyrolyseprodukter.
Pyrolyse er oppvarming av organiske stoffer til høye temperaturer uten lufttilgang. I dette tilfellet oppstår dekomponering, eller spaltning, av komplekse forbindelser til enklere (koksing av kull, krakking av olje, tørr destillasjon av tre). Derfor er forbrenningen av et fast brennbart stoff til et forbrenningsprodukt ikke kun konsentrert i flammesonen, men har en flertrinnskarakter.
Oppvarming av den faste fasen forårsaker nedbrytning og frigjøring av gasser, som antennes og brenner. Varmen fra fakkelen varmer opp den faste fasen, noe som får den til å forgasse og prosessen gjentas, og dermed opprettholdes forbrenningen.
Forbrenningsmodell fast antar tilstedeværelsen av følgende faser (fig. 17):
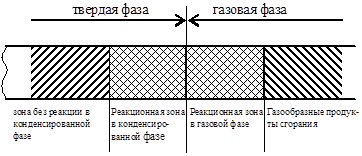
Ris. 17. Forbrenningsmodell
fast stoff.
Varmer opp den faste fasen. For smeltende stoffer skjer smelting i denne sonen. Tykkelsen på sonen avhenger av konduktivitetstemperaturen til stoffet;
Pyrolyse, eller reaksjonssone i fast fase, hvor gassformige brannfarlige stoffer dannes;
Forflamme i gassfasen, der en blanding med et oksidasjonsmiddel dannes;
Flamme, eller reaksjonssone i gassfasen, der produktene fra pyrolyse omdannes til gassformige forbrenningsprodukter;
Forbrenningsprodukter.
Hastigheten av oksygentilførselen til forbrenningssonen avhenger av dens diffusjon gjennom forbrenningsproduktet.
Generelt, siden hastigheten på den kjemiske reaksjonen i forbrenningssonen i de aktuelle forbrenningstypene avhenger av hastigheten for inngangen til de reagerende komponentene og flammeoverflaten gjennom molekylær eller kinetisk diffusjon, kalles denne typen forbrenning. diffusjon.
Strukturen til diffusjonsforbrenningsflammen består av tre soner (fig. 18):
Sone 1 inneholder gasser eller damper. Det er ingen forbrenning i denne sonen. Temperaturen overstiger ikke 500 0 C. Dekomponering, pyrolyse av flyktige stoffer og oppvarming til selvantennelsestemperaturen skjer.
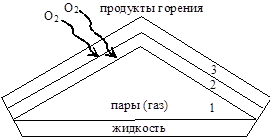
Ris. 18. Flammestruktur.
I sone 2 dannes en blanding av damper (gasser) med atmosfærisk oksygen og ufullstendig forbrenning skjer til CO med delvis reduksjon til karbon (lite oksygen):
CnHm + O2 -> CO + CO2 + H20;
I den tredje ytre sonen oppstår fullstendig forbrenning av produktene fra den andre sonen, og maksimal flammetemperatur observeres:
2CO+02=2C02;
Flammehøyden er proporsjonal med diffusjonskoeffisienten og gassstrømningshastigheten og omvendt proporsjonal med gasstettheten.
Alle typer diffusjonsforbrenning er iboende i branner.
Kinetisk Forbrenning er forbrenning av ferdigblandet brannfarlig gass, damp eller støv med et oksidasjonsmiddel. I dette tilfellet avhenger brennhastigheten bare av de fysisk-kjemiske egenskapene til den brennbare blandingen (varmeledningsevne, varmekapasitet, turbulens, konsentrasjon av stoffer, trykk, etc.). Derfor øker brennhastigheten kraftig. Denne typen forbrenning er iboende i eksplosjoner.
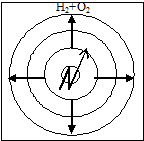 I dette tilfellet, når den brennbare blandingen antennes når som helst, beveger flammefronten seg fra forbrenningsproduktene inn i den ferske blandingen. Dermed er flammen under kinetisk forbrenning oftest ustø (fig. 19).
I dette tilfellet, når den brennbare blandingen antennes når som helst, beveger flammefronten seg fra forbrenningsproduktene inn i den ferske blandingen. Dermed er flammen under kinetisk forbrenning oftest ustø (fig. 19).
Ris. 19. Plan for flammeutbredelse i en brennbar blanding: - antennelseskilde; - bevegelsesretningen til flammefronten.
Skjønt, hvis du blander det først brennbar gass med luft og mat den inn i brenneren, så ved tenning dannes en stasjonær flamme, forutsatt at strømningshastigheten til blandingen er lik hastigheten på flammeutbredelsen.
Hvis gasstilførselshastigheten økes, bryter flammen vekk fra brenneren og kan gå ut. Og reduseres hastigheten vil flammen trekkes inn i brenneren med en mulig eksplosjon.
I henhold til forbrenningsgrad, dvs. fullstendighet av forbrenningsreaksjonen til sluttproduktene, oppstår forbrenning komplett og ufullstendig.
Så i sone 2 (fig. 18) er forbrenningen ufullstendig, fordi Det er utilstrekkelig oksygentilførsel, som delvis forbrukes i sone 3, og mellomprodukter dannes. Sistnevnte brenner ut i sone 3, hvor det er mer oksygen, inntil fullstendig forbrenning. Tilstedeværelsen av sot i røyken indikerer ufullstendig forbrenning.
Et annet eksempel: når det er mangel på oksygen, brenner karbon til karbonmonoksid:
Hvis du legger til O, blir reaksjonen fullført:
2СО+O 2 =2СО 2.
Forbrenningshastigheten avhenger av arten av bevegelsen av gasser. Derfor skilles det mellom laminær og turbulent forbrenning.
Et eksempel på laminær forbrenning er således en stearinlysflamme i stille luft. På laminær forbrenning lag av gasser strømmer parallelt, uten å virvle.
Turbulent forbrenning– virvelbevegelse av gasser, der forbrenningsgasser blandes intensivt og flammefronten er uskarp. Grensen mellom disse typene er Reynolds-kriteriet, som karakteriserer forholdet mellom treghetskrefter og friksjonskrefter i strømmen:
Hvor: u- gassstrømhastighet;
n- kinetisk viskositet;
l– karakteristisk lineær størrelse.
Reynolds-tallet der overgangen av et laminært grenselag til et turbulent skjer, kalles kritisk Re cr, Re cr ~ 2320.
Turbulens øker forbrenningshastigheten på grunn av mer intens varmeoverføring fra forbrenningsprodukter til den ferske blandingen.
4.4. Normal forbrenning.
Avhengig av hastigheten på flammeutbredelsen under kinetisk forbrenning, kan enten normal forbrenning (innen noen få m/s), eller eksplosiv deflagrasjon (ti titalls m/s), eller detonasjon (tusenvis av m/s) oppstå. Disse typer forbrenning kan forvandles til hverandre.
Normal forbrenning– dette er forbrenning der spredning av flamme skjer i fravær av ytre forstyrrelser (turbulens eller endringer i gasstrykk). Det avhenger kun av arten av det brennbare stoffet, dvs. termisk effekt, varmeledningsevne og diffusjonskoeffisienter. Derfor er det en fysisk konstant av en blanding av en viss sammensetning. I dette tilfellet er brennhastigheten vanligvis 0,3-3,0 m/s. Forbrenning kalles normal fordi hastighetsvektoren for dens utbredelse er vinkelrett på flammefronten.
4.5. Deflagrasjon (eksplosiv) forbrenning.
Normal forbrenning er ustabil og har en tendens til å akselerere seg selv i et lukket rom. Årsaken til dette er krumningen av flammefronten på grunn av friksjon av gassen mot karets vegger og endringer i trykk i blandingen.
La oss vurdere prosessen med flammeutbredelse i et rør (fig. 20).
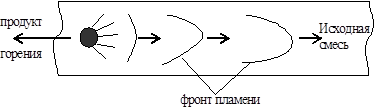
Ris. 20. Plan for forekomsten av eksplosiv forbrenning.
Først, i den åpne enden av røret, sprer flammen seg med normal hastighet, fordi forbrenningsprodukter utvider seg fritt og kommer ut. Trykket i blandingen endres ikke. Varigheten av jevn flammeutbredelse avhenger av rørets diameter, typen drivstoff og konsentrasjonen.
Når flammefronten beveger seg inne i røret, har ikke reaksjonsproduktene, som har et større volum sammenlignet med den opprinnelige blandingen, tid til å rømme utenfor og trykket øker. Dette trykket begynner å presse i alle retninger, og derfor, foran flammefronten, begynner den første blandingen å bevege seg mot spredningen av flammen. Lagene som grenser til veggene er hemmet. Flammen har den høyeste hastigheten i midten av røret, og den laveste hastigheten er nær veggene (på grunn av varmefjerning i dem). Derfor strekker flammefronten seg i retning av flammeutbredelse, og overflaten øker. I forhold til dette øker mengden brennbar blanding per tidsenhet, noe som medfører en trykkøkning, og dette øker igjen hastigheten på gassbevegelsen osv. Dermed er det en skredlignende økning i hastigheten på flammeutbredelsen til hundrevis av meter per sekund.
Prosessen med flammeutbredelse gjennom en brennbar gassblanding, der den selvakselererende forbrenningsreaksjonen sprer seg på grunn av oppvarming ved termisk ledning fra det tilstøtende laget av reaksjonsprodukter, kalles deflagrasjon. Typisk er deflsubsoniske, dvs. mindre enn 333 m/s.
4.6. Detonasjonsforbrenning.
Hvis vi vurderer forbrenningen av en brennbar blanding lag for lag, så som et resultat av termisk utvidelse av volumet av forbrenningsprodukter, hver gang en kompresjonsbølge vises foran flammefronten. Hver påfølgende bølge, som beveger seg gjennom et tettere medium, fanger opp med den forrige og legges over den. Gradvis kombineres disse bølgene til én sjokkbølge (fig. 21).
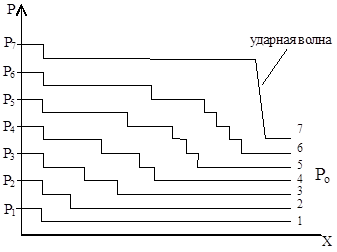
Ris. 21. Skjema for dannelse av en detonasjonsbølge: R o< Р 1 < Р 2 < Р 3 < Р 4 < Р 5 < Р 6 < Р 7 ; 1-7 – нарастание давления в слоях с 1-го по 7-ой.
I en sjokkbølge, som et resultat av adiabatisk kompresjon, øker tettheten av gasser øyeblikkelig og temperaturen stiger til T 0 for selvantennelse. Som et resultat blir den brennbare blandingen antent av en sjokkbølge og en detonasjon– forplantning av forbrenning ved antennelse av en sjokkbølge. Detonasjonsbølgen går ikke ut, pga drevet av sjokkbølger fra flammen som beveger seg bak den.
Det særegne ved detonasjon er at det skjer ved en supersonisk hastighet på 1000-9000 m/s, bestemt for hver blandingssammensetning, og derfor er en fysisk konstant for blandingen. Det avhenger bare av kaloriinnholdet i den brennbare blandingen og varmekapasiteten til forbrenningsproduktene.
Møtet av en sjokkbølge med en hindring fører til dannelsen av en reflektert sjokkbølge og enda større trykk.
Detonasjon er mest farlig utseende flammen spredte seg, fordi Det har maksimal effekt eksplosjon (N=A/t) og enorm fart. I praksis kan detonasjon «nøytraliseres» kun i pre-detonasjonsdelen, dvs. i avstand fra tenningspunktet til punktet for detonasjonsforbrenning. For gasser er lengden på denne delen fra 1 til 10 m.
[Forrige forelesning] [For ikke å se noen reklame på nettstedet, må du bli VIP-bruker.Dette kan gjøres helt gratis. Lese.
Forelesning 14
BRANNSIKKERHET
1.Generell informasjon om forbrenningsprosessen
Grunnleggende definisjoner
Typer forbrenning
Forbrenningsprosess
Hovedindikatorer for brannfare for stoffer
Klassifisering av stoffer etter brannfare
2. De viktigste brannkildene i bedriften, under transport og lagring av flytende gasser og hydrokarboner. Karakter brannfare industribedrifter.
3. Klassifisering av produksjonsanlegg og områder etter brann- og eksplosjonsfare
Arrangementer for branntiltak. P.p. industribygg.
1. Generell informasjon om forbrenningsprosessen
Grunnleggende definisjoner
Brann - ukontrollert forbrenning utenfor en spesiell peis, forårsaker materiell skade (standarddefinisjon).
For personer i tilfelle brann farlige faktorer er:
åpen ild, gnister, økt temperatur på luft og gjenstander;
strålende energistrømmer, økt miljøtemperatur, innånding av varm luft, skade og nekrose av øvre luftveier
giftige forbrenningsprodukter, røyk, luftmangel av oksygen
tap av sikt på grunn av røyk
kollaps av bygninger og deres elementer, installasjoner, utstyr
Giftige stoffer som dannes under en brann er forårsaket av den kjemiske sammensetningen av det brennende stoffet: hår, lær, stoffer, ull - produkter med ubehagelig lukt, cyanidforbindelser som inneholder brus, aldehyder, ketoner, gummi, gummi - isopren, hydrokarboner, lakk, produkter som inneholder nevrocelluloid - CO , N 2 O, HCN, Plast, celluloid - CO, N 2 O, cyanid, formaldehyd, fenol, fluorfosfin, ammoniakk, aceton, styren, etc. er svært giftige forbindelser.
Soling - brenning som ikke forårsaket materielle skader.
En person som har fått andregradsforbrenninger over 30 % av kroppsarealet har liten sjanse til å overleve (uten spesialisert medisinsk behandling). Tid for å oppnå II grads forbrenninger:
26 s ved t = 71 C
15c ved t = 100С
7s ved t= 176С.
Studier utført i Canada har vist at i et fuktig miljø, typisk for en brann, forårsakes II grads forbrenninger av t = 55°C når de eksponeres i 28 s og 70°C i 1 s.
I en brann i varehuset Invation i Brussel omkom således 350 mennesker og 150 ble skadet på 10 minutter med brann. I løpet av denne tiden ble et stort varehus, som okkuperte en hel hektar, til en brann.
1.2. Typer forbrenning
Forbrenning - en raskt forekommende kjemisk reaksjon (oftest oksidasjon), ledsaget av frigjøring av en stor mengde varme og vanligvis en lys glød (flamme).
Forbrenning krever tilstedeværelse av 3 faktorer:
oksidasjonsmiddel (vanligvis O 2, også Cl, F, Br, I, NOX)
brannfarlig stoff
tennkilde (dvs. begynnelsen av pulsen).
Avhengig av egenskapene og sammensetningen til det brennbare stoffet, skilles følgende:
A. Homogen forbrenning (samme aggregatsammensetning, for eksempel gasser)
B. Heterogen forbrenning (f.eks. fast og flytende).
Avhengig av hastigheten på flammeutbredelsen, er det:
A. Deflagrasjon (typisk for branner)
B. Eksplosiv 100 m/s
B. Detonasjon 1000 m/s5000 m/s
Avhengig av forholdene for dannelsen av den brennbare blandingen:
Diffusjonsforbrenning - karakterisert ved at dannelsen av en brennbar blanding skjer under forbrenningsprosessen som et resultat av diffusjon av oksygen inn i forbrenningssonen. For eksempel forbrenning av væske fra en åpen overflate eller gasser som slipper ut gjennom utstyrslekkasjer
Deflagrasjonsforbrenning er diffusjonsforbrenning.
Kinetisk forbrenning tilsvarer eksplosiv forbrenning. I dette tilfellet kommer det brennbare stoffet og oksygen inn i forbrenningssonen forblandet. Den avgjørende faktoren er hastigheten på den kjemiske oksidasjonsreaksjonen mellom oksidasjonsmidlet og det brennbare stoffet, som skjer i flammefronten. Hvis prosessen med kinetisk forbrenning skjer i et lukket volum, øker trykket i dette volumet og temperaturen til forbrenningsproduktene øker.
Basert på forholdet mellom drivstoff og oksidasjonsmiddel er de delt inn i:
A. Forbrenning av magre brennbare blandinger (i emnet - et oksidasjonsmiddel, er forbrenning begrenset av tilkoblingen av den brennbare komponenten).
B. Forbrenning av rike brannfarlige blandinger - følgelig, tvert imot - drivstoffet begrenser innholdet av oksidasjonsmidlet (inneholder en luftfukter høyere enn det metriske glassforholdet til komponentene).
Forekomsten av forbrenning er forbundet med den obligatoriske selvakselerasjonen av reaksjonen. Det er 3 typer selvakselerasjon:
termisk: utsatt for akkumulering av varme i systemet, stiger temperaturen, noe som fører til akselerasjon av kjemiske reaksjoner;
kjede: assosiert med katalyse av kjemiske transformasjoner av mellomreaksjonsprodukter, har spesiell kjemisk aktivitet (aktive sentre). (dvs. den kjemiske prosessen skjer ikke gjennom direkte interaksjon av de opprinnelige molekylene, men ved hjelp av fragmenter dannet under nedbrytningen av disse molekylene).
Virkelige forbrenningsprosesser utføres vanligvis av en kombinert kjede-termisk mekanisme.
1.3 Typer forbrenningsprosesser
Blits - rask (nesten øyeblikkelig) forbrenning av brennbare blandinger, ikke ledsaget av dannelse av komprimerte gasser.
Brann - forekomsten av forbrenning under påvirkning av en tennkilde (сttenning eller selvantennelse)
Tenning - brann ledsaget av utseendet til en flamme.
Selvantennelse - en kraftig økning i hastigheten på eksoterme reaksjoner som fører til forbrenning av et stoff (blanding) i fravær av en tennkilde. Dette kan også skje ved omgivelsestemperaturantennelsestemperatur. Denne muligheten skyldes stoffers tendens til å oksidere og betingelsene for akkumulering av varme som frigjøres under oksidasjon. Under spontan forbrenning er det så å si en indre impuls.
Avhengig av impulsen er spontane forbrenningsprosesser delt inn i:
termisk,
mikrobiologiske,
kjemisk.
Termisk selvantennelse/spontan forbrenning oppstår som følge av langvarig eksponering for en ubetydelig varmekilde. I dette tilfellet brytes stoffene ned, adsorberes og, som et resultat av oksidative prosesser, antennes spontant. Så ved temperatur100С er de utsatt for spontan forbrenning sagflis, fiberplater, parkett.
Kjemisk Spontan forbrenning/spontan forbrenning oppstår ved eksponering av stoffer for oksygen i luft, vann, eller fra interaksjon av stoffer. (Brann fra spontan forbrenning av oljete filler, kjeledresser, bomullsull og noen ganger til og med metallspon).
Tendensen til en olje eller et fett til spontan forbrenning kan bedømmes ut fra jodtallet (mengden I2 absorbert av 100 g av oljen eller fettet som testes).
Jo høyere jodtallet er, jo lavere er selvantennelsestemperaturen, desto farligere er stoffet.
Mikrobiologisk spontan forbrenning - ved passende fuktighet og temperatur i planteprodukter med intensivering av den vitale aktiviteten til organismer (det dannes en sopp - den såkalte spindelvev-litharge), som forårsaker en økning i temperaturen.
(For å forhindre - regelmessig overvåking av temperatur og fuktighet, begrense fuktighet og temperatur
Selvantenning - spontan forbrenning ledsaget av utseendet til en flamme.
Eksplosjon - en ekstremt rask kjemisk transformasjon, ledsaget av frigjøring av energi og komprimerte gasser som er i stand til å produsere arbeid.
Detonasjon - varmeoverføring fra lag til lag skjer på grunn av forplantningen av en sjokkbølge.
Ved vurdering av stoffers brannfare er det nødvendig å ta hensyn til deres aggregeringstilstand.
Siden forbrenning vanligvis skjer i gassmiljø, som indikatorer for brannsikkerhet (FS), er det nødvendig å ta hensyn til forholdene under hvilke en tilstrekkelig mengde gassformige produkter dannes for forbrenning.




