П р и м е р.
Вычислите константу химического равновесия для обратимой гомогенной реакции, СО + Н 2 О = СО 2 + Н 2 , исходя из того, что равновесие концентрации веществ:
[СО] р = 0,045 моль/л,
[Н 2 О] р = 0,064 моль/л,
[СО 2 ] р = 0,18 моль/л.
Дано:
[СО] р = 0,045 моль/л
[Н 2 О] р = 0,064 моль/л
[СО 2 ] р = 0,18 моль/л
Решение:
Молярное отношение продуктов реакции 1:1, поэтому
[СО 2 ] р = [Н 2 ] р = 0,18 моль/л.
Исходя из выражения (2.1) рассчитываем величину константы химического равновесия:
К х.р = [СО 2 ] р [Н 2 ] р / [СО 2 ] р [Н 2 О] р = 0,18 · 0,18/0,045 · 0,064
Ответ: 11,25.
2. Вычисление равновесных концентраций по исходным концентрациям реагирующих веществ и наоборот
П р и м е р 1.
Обратимая газовая реакция протекает по уравнению:
СО + CI 2 = COCI 2 .
Исходные концентрации реагирующих веществ:
[СО] 0 = 0,03 моль/л;
0 = 0,02 моль/л.
После наступления равновесия концентрация угарного газа стала:
[СО] р = 0,021 моль/л.
Вычислить равновесные концентрации остальных веществ и величину константы химического равновесия.
Дано:
[СО] 0 = 0,03 моль/л
[С1 2 ] 0 = 0,02 моль/л
[СО] р = 0,021 моль/л
P , p , K x . p – ?
Решение:
К моменту равновесия изменение концентрации СО составило:
∆[СО] = [СО] 0 – [СО] р = 0,03 – 0,021 = 0,009 моль/л.
Поскольку молярное отношение веществ, участвующих в реакции 1:1:1, то изменение концентрации всех веществ одинаково:
[С1 2 ] р = [С1 2 ] 0 – ∆[С1 2 ] = 0,02 – 0,009 = 0,011 моль/л,
[СОС1 2 ] р = 0,009 моль/л,
К х·р = [СОС1 2 ] Р / [СО] Р [С1 2 ] р = 0,009/0,021 · 0,011 = 39.
Результаты вычислений внесем в таблицу, где знаки «+» и «–» означают соответственно увеличение или понижение концентрации вещества.
Ответ: [С1 2 ] р = 0,011 моль/л; [СОС1 2 ] р = 0,009 моль/л; К х·р = 39.
П р и м е р 2.
Равновесные концентрации веществ, участвующих в обратимой реакции 2NO + О 2 = 2NО 2 , следующие (моль/л):
Р = 0,056;
[О 2 ] = 0,028;
Дано:
Р = 0,056 моль/л
Р = 0,028 моль/л
Р = 0,044 моль/л
0 , [О 2 ] 0 – ?
Решение:
Начальная концентрация оксида азота (IV) была 0 = 0, а ее изменение к моменту равновесия составляет ∆ = 0,044 моль/л.
Молярное отношение NO и NО 2 в реакции 2:2 (1:1), следовательно, начальная концентрация NO будет:
0 = р + 0,044 = 0,056 + 0,044 = 0,1 моль/л.
Молярное отношение О 2 и NO 2 составляет 1:2, отсюда начальная концентрация О 2 будет:
[О 2 ] 0 = [О 2 ] р + 0,044/2 = 0,028 + 0,022 = 0,05 моль/л.
Результаты вычислений записываем в таблицу
Ответ: 0 = 0,1 моль/л; [О 2 ] 0 = 0,05 моль/л.
П р и м е р 3.
Реакция синтеза аммиака протекает по уравнению ЗН 2 + N 2 = 2NH 3 . Начальные концентрации исходных веществ равны (моль/л): водорода – 0,05; азота – 0,04: константа скорости реакции равна 0,3. Рассчитать: а) начальную скорость реакции; б) скорость реакции, когда концентрация аммиака стала равной 0,02 моль/л.
Дано:
а) [Н 2 ] 0 = 0,05 моль/л
0 = 0,04 моль/л
б) = 0,02 моль/л
Решение:
а) В соответствии с законом действующих масс находим начальную скорость реакции:
υ 0 = k 0 3 0 = 3 · 10 –1 3 = 1,5 · 10 –6 моль/л·с.
б) Исходя из уравнения реакции молярное отношение водорода и аммиака 3:2. Увеличение концентрации аммиака на 0,02 моль/л вызывает уменьшение концентрации водорода на 0,03 моль/л (0,02 – 3/2 = 0,03).
Таким образом, к моменту когда концентрация аммиака выросла на 0,02 моль/л, концентрация водорода уменьшилась до 0,02 моль/л (0,05 – 0,03 = 0,02). Молярное отношение азота и аммиака 1:2. Концентрация азота уменьшится на 0,01 моль (0,02 – 1/2 = = 0,01) и станет равной 0,03 моль/л (0,04 – 0,01 = 0,03). Скорость реакции с уменьшением концентрации реагирующих веществ также понизится:
υ = k 3 = 3 · 10 –1 3 = 7,2 · 10 –8 моль/л·с.
Ответ: а) 1,5 · 10 –6 моль/л·с; б) 7,2 · 10 –8 моль/л·с.
П р и м е р 4.
Реакция протекает по уравнению 2NO + О 2 = 2NO 2 , через некоторое время после начала реакции концентрации всех веществ, участвующих в реакции, стали: = 0,04 моль/л; [О 2 ] = 0,01 моль/л; = 0,02 моль/л. Рассчитать начальные концентрации исходных веществ и начальную скорость реакции, если константа скорости реакции k = 1.
Дано:
0,04 моль/л
[О 2 ] = 0,01 моль/л
0,02 моль/л
0 , 0 , x 0 – ?
Решение:
В соответствии с уравнением реакции молярное отношение NO и NO 2 равно 2:2 (1:1).
Увеличение концентрации продукта реакции NO 2 до 0,02 моль/л вызвало уменьшение концентрации NO на 0,02 моль. Следовательно, начальная концентрация оксида азота (II) была:
0 = +0,02 = 0,04 + 0,02 = 0,06 моль/л.
Молярное отношение О 2 и NO 2 составляет 1:2, поэтому повышение концентрации NO 2 до 0,02 моль вызвало уменьшение концентрации кислорода на 0,01 моль (0,02 · 1/2 = 0,01). В результате начальная концентрация кислорода была:
[О 2 ] 0 = [О 2 ] + 0,01 = 0,01 + 0,01 = 0,02 моль/л.
Начальная скорость реакции
υ 0 = k 0 2 0 = 1 2 = 7,2 · 10 –5 моль/л·с.
Ответ: 0 = 0,06 моль/л; [О 2 ] 0 = 0,02 моль/л;
х 0 = 7,2 · 10 –5 моль/л·с.
Химическим равновесием называется такое состояние обратимой химической реакции
aA + b B = c C + d D,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия :
где C i – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли X i компонентов:
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления P i компонентов:
Для идеальных газов P i = C i RT и P i = X i P , где P – общее давление, поэтому K P , K C и K X связаны следующим соотношением:
K P = K C (RT) c+d–a–b = K X P c+d–a–b . (9.4)
Константа равновесия связана с r G o химической реакции:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Изменение r G или r F в химической реакции при заданных (не обязательно равновесных) парциальных давлениях P i или концентрациях C i компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа ):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Согласно принципу Ле Шателье , если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа )
![]() (9.9)
(9.9)
и изохоры химической реакции (изохоры Вант-Гоффа )
![]() . (9.10)
. (9.10)
Интегрирование уравнения (9.9) в предположении, что r H реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
где C – константа интегрирования. Таким образом, зависимость ln K P от 1/Т должна быть линейной, а наклон прямой равен – r H /R .
Интегрирование в пределах K 1 , K 2 , и T 1, T 2 дает:
 (9.13)
(9.13)
 (9.14)
(9.14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать r H реакции. Соответственно, зная r H реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K. f G o для CO(г) и CH 3 OH(г) при 500 К равны –155.41 кДж. моль –1 и –134.20 кДж. моль –1 соответственно.
Решение. G o реакции:
r G o = f G o (CH 3 OH) – f G o (CO) = –134.20 – (–155.41) = 21.21 кДж. моль –1 .
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Пример 9-2. Константа равновесия реакции
равна K P = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N 2 и H 2 , чтобы 10% N 2 превратилось в NH 3 ? Газы считать идеальными.
Решение. Пусть прореагировало моль N 2 . Тогда
| N 2 (г) | + | 3H 2 (г) | = | 2NH 3 (г) | |
| Исходное количество | 1 | 1 | |||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2) | ||
| Равновесная мольная доля: |
Следовательно, K
X =  и K P = K X . P
–2
=
и K P = K X . P
–2
=  .
.
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 = , откуда P
= 51.2 атм.
, откуда P
= 51.2 атм.
Пример 9-3. Константа равновесия реакции
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H 2 и 1 моль инертного газа (N 2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H 2 (г) | = | CH 3 OH(г) | |
| Исходное количество: | 1 | 2 | 0 | ||
| Равновесное количество: | 1– | 2–2 | |||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N 2 = 4–2 моль | ||||
| Равновесная мольная доля | |||||
Следовательно, K
X =  и K P = K X . P –2
=
и K P = K X . P –2
= ![]() .
.
Таким образом, 6.09 10 –3
= ![]() .
.
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: = 0.288, = 0.106, = 0.212 и = 0.394.
Пример 9-4. Для реакции
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 298 К K P = 6.0 10 5 , а f H o (NH 3) = –46.1 кДж. моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
r H o = 2 f H o (NH 3) = –92.2 кДж. моль –1 .
Согласно уравнению (9.14), 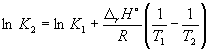 =
=
Ln (6.0 10 5) + ![]() = –1.73, откуда K
2 =
0.18.
= –1.73, откуда K
2 =
0.18.
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
- При 1273 К и общем давлении 30 атм в равновесной смеси
- При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
- Константа равновесия реакции
- Константа равновесия реакции
- Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I 2 , нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
- Для реакции
- Для реакции
- Сосуд объемом 1 л, содержащий 0.341 моль PCl 5 и 0.233 моль N 2 , нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
- Константа равновесия реакции
- При 25 o C f G o (NH 3) = –16.5 кДж. моль –1 . Рассчитать r G реакции образования NH 3 при парциальных давлениях N 2 , H 2 и NH 3 , равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
- Экзотермическая реакция
- Константа равновесия газофазной реакции изомеризации борнеола (C 10 H 17 OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
- Равновесие в реакции
- Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H 2 и 1 части N 2 , чтобы получить равновесную смесь, содержащую 10% NH 3 по объему при 400 o C. Константа равновесия для реакции
- При 250 o C и общем давлении 1 атм PCl 5 диссоциирован на 80% по реакции
- При 2000 o C для реакции
- Рассчитать стандартную энтальпию реакции, для
которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К. - Зависимость константы равновесия реакции 2C 3 H 6 (г) = C 2 H 4 (г) + C 4 H 8 (г) от температуры между 300 К и 600 К описывается уравнением
CO 2 (г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO 2 . Сколько процентов CO 2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO 2 ?
H 2 O(г) = H 2 (г) + 1/2O 2 (г) при этих условиях.
CO(г) + H 2 O(г) = CO 2 (г) + H 2 (г)
при 500 o C равна K p = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H 2 O, нагрели до этой температуры. Рассчитать мольную долю H 2 O в равновесной смеси.
N 2 O 4 (г) = 2NO 2 (г)
при 25 o C равна K p = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N 2 O 4 при этой температуре.
I 2 (г) = 2I (г).
при 250 o C r G o = –2508 Дж. моль –1 . При каком общем давлении степень превращения PCl 5 в PCl 3 и Cl 2 при 250 o C составит 30%?
2HI(г) = H 2 (г) + I 2 (г)
константа равновесия K P = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I 2 и 0.2 г H 2 в трехлитровом сосуде? Чему равны парциальные давления H 2 , I 2 и HI?
PCl 5 (г) = PCl 3 (г) + Cl 2 (г)
CO(г) + 2H 2 (г) = CH 3 OH(г)
при 500 K равна K P = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H 2 взяты в соотношении 1: 2.
CO(г) + 2H 2 (г) = CH 3 OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T ; б) повышение P ; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H 2 при P = const?
2NOCl(г) = 2NO(г) + Cl 2 (г)
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать r G o для реакции. При каком общем давлении парциальное давление Cl 2 будет равно 0.10 бар?
N 2 (г) + 3H 2 (г) = 2NH 3 (г)
при 400 o C равна K = 1.60 10 –4 .
PCl 5 (г) = PCl 3 (г) + Cl 2 (г).
Чему будет равна степень диссоциации PCl 5 , если в систему добавить N 2 , чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
N 2 (г) + O 2 (г) = 2NO(г)
K p = 2.5 10 –3 . В равновесной смеси N 2 , O 2 , NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N 2 и 16% O 2 . Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Пример 1 . Вычислить изменение энергии Гиббса ΔG в реакции димеризации диоксида азота 2NО 2(г) = N 2 O 4(г) при стандартной температуре 298 К, 273 К и 373 К. Сделать вывод о направлении процесса. Определить константы равновесия реакции димеризации диоксида азота при выше указанных температурах. Определить температуру, при которой Δ G = 0. Сделайте вывод о направлении этой реакции выше и ниже этой температуры. Термодинамические характеристики компонентов:
ΔΗ° 298 S o 298
В-во кДж/моль Дж/моль*K
NO 2 (г) 33,3 240,2
N 2 O 4(г) 9,6 303,8
Решение. Для обратимого процесса:
aA (г) + bB (г) ⇄ сС (г) + dD (г)
выражение для константы равновесия K р будет
K р =(P c C *P d D)/(P a A *P b B)
где P A , P B , P C , P D - равновесные парциальные давления газообразных компонентов А,В,С,D a, b, c, d - стехиометрические коэффициенты.
Для процесса aA (ж) +bB (ж
) ⇄ сC
(ж) +dD (ж) выражение для константы равновесия
K c = (C c C *C d D)/(C a A *C b B)
где C A , C B , C C , C D - равновесные концентрации веществ А,В,С,D a, b, c, d - стехиометрические коэффициенты.
По формуле (1.4.1) для системы 2NO 2 ⇄ N 2 O 4 имеем
K р =P N 2 O 4 /P 2 NO 2
При стандартной температуре 298 K изменение энтальпии (ΔH o реакции) определим по формуле (1.2.2)
ΔH o реакции = ΔΗ° 298 N 2 O 4 - 2ΔΗ° 298 NO 2 = 9,6-2*33,5 = -57400 Дж.
Изменение энтропии (1.3.5)
ΔS o реакции = S° 298 N2O4 - 2S° 298 NO2 =303,8-2* (240 ,2)=-176 Дж/моль*К
Пользуясь принципом Ле-Шателье, который говорит о том, что при изменении условий, при которых обратимая реакция находится в состоянии равновесия, равновесие сместится в сторонy процесса ослабевающего изменения, предскажем направление смещения равновесия. Значение ΔΗ о отрицательно, следовательно реакция образования экзотермическая (идет c выделением тепла) и при понижении температуры равновесие должно смещаться вправо, при повышении температуры - влево. Кроме того, по фopмyлe (1.3.6), зная, что ΔH
ΔG o 273 ; ΔG o 298 ; ΔG o 373 и K 273 ; K 298 ; K 373
Значение энергии Гиббса для заданных температур рассчитаем по формуле (1.3.7):
ΔG o 298 =ΔH o -TΔS o =-57400-298*(-176)=-4952Дж.,
ΔG o 273 =-57400-273*(-176)=-9352Дж:
ΔG o 373 =-57400-373*(-176)= 7129 Дж.
Отрицательное значение ΔG o 298 говорит о смещении равновесия реакции вправо, а более высокое отрицательное значение ΔG o 273 свидетельствует о том, что при снижении температуры от (298 до 273 К) равновесие смещается вправо.
Положительное значение ΔG o 373 указывает на изменение направления самопроизвольного процесса. При этой температуре предпочтительнее становится обратная реакция (смещение равновесия влево).
Константы равновесия К p и энергию Гиббса ΔG o связывает формула
где К p - константа равновесия процесса; R - газовая постоянная; T - абсолютная температура. По формуле (1.4.3) имеем:
lnK 273 =- ΔG o 273 /RT=9352/8,31*273=4,12
lnK 298 = -ΔG o 298 /RT=4952/8,31*298=2
lnK 373 = -ΔG o 373 /RT=-7129/8,31*298=-2,3
значение К 298 и K 273 > 1 показывает на смещение равновесия вправо (сравни с (1.4.1)) и тем больше, чем выше значение константы равновесия. K 373 < 1, говорит ο смещении равновесия в системе влево (сравни с (1.4.1)).
Условию ΔG o реакции =0 отвечает константа равновесия,
равная единице.
Рассчитаем температуру Т, соответствующую этой константе по формуле (1.3.7):
ΔG°=ΔΗ°-TΔS o ; O=ΔH o -TΔS o ;
T Δ G =0 =ΔΗ°/ΔS°=57400/176=326,19 K
Вывод. При температуре 326,19 K прямая и обратная реакции протекают c одинаковой вероятностью, K р =1. С понижением температуры равновесие будет смещаться вправо с повышением влево.
Пример 2 . Константа равновесия К р реакции синтеза NH 3 по реакции N2+3 H2==2NH 3 при 623 K равна 2,32*10 -13 . Вычислить К с при той же температуре.
Решение. Связь К р и К с осуществляется по формуле
K p = K c (RT) Δ n , (1.4.4)
Δn= n 2 - n 1 =2-4= -2, где n 1 и n 2 количество молей peaгентов и продуктов. Следовательно,
K c =K p /(RT) Δ n =0,624*10 -5
Ответ . К = 0,624*10 -5 .
Пример 2. Упругость диссоциации карбоната кальция при 1154 К равна 80380 Па, а при 1164 K - 91177 Па. Рассчитать, при какой температуре упругость диссоциации карбоната кальция будет равна 101325 Па.
Решение. Реакция диссоциации CaCO 3(кр) ⇄ CaO (кр) +СО 2(г)
Отсюда по (1.4.1)
K p =P CO 2
Следовательно, при каждой температуре (Т 1 - 1154 K; Τ =1164 К* Τ = X) константы равновесия будут соответствовать давлению:
K T 1 = 80380; K T 2 = 91177; K T 3 = 101325.
Зависимость константы равновесия от температуры показывает уравнение Аррениуса
dlnK p /dT= ΔΗ/RT 2 (1.4.5)
где К p - константа равновесия; Τ - температура, К; ΔΗ - тепловой эффект реакции; R - газовая постоянная.
Интегрируя уравнение (1.4.5) в интервале температур Т 1 -Т 2 при Δ H= соnst получим
lnK T 1 /K T 2 = ΔΗ/R(1/T 1 -1/T 2),
Где K T 1 и K T 2 – константы равновесия при T 1 и T 2 .
Определим сначала ΔΗ (по 1.4.6)
ΔΗ=ln(91177*8,31*1154*1164/80380*10)=140500 Дж/моль.
ln(101325/91177)=140500/8,31(1/1164-1/T 3)
T 3 =1172 K
Ответ.
При Т=1172К упругость диссоциации карбоната кальция будет равна 101325 Па.
Задачи
56. Константа диссоциации уксусной кислоты при 298 К равна 1,75*10 -5 . Чему равно изменение энергии Гиббса диссоциации уксусной кислоты?
57. Найти значение энергии Гиббса (ΔG o 298) и константы равновесия K 298 для реакции BaSО 4(кр) → Ba 2+ (р) + SО 2- 4(p) .
Для расчета использовать следующие данные:
Вещество S о 298 Дж/моль*К ΔH o 298 кДж/моль 2 ^ 2^
BaSO 4(кр) 132,4 -1447,39
Ba 2+ (р) 9,64 -533,83
SO 2- 4 (р) 18,44 -904,2.
58. Найти константу равновесия при 473 К для реакции гидратации этилена
С 2 Н 4(г) + H 2 O (г) =С 2 Н 5 ОН (г) .
Свойства реагентов взять в табл. 3. Зависимостью ΔS и ΔH от температуры пренебречь.
59. Считая, что ΔH o 298 и ΔS о 298 реакции 4HCl+O 2 ⇄ 2Н 2 О + 2Сl 2 не зависят от температуры, найти температуру, при которой
К р =1, а ΔG o = О.
60. Пользуясь табличными данными, вычислить константы равновесия следующих реакций при 298 К и при 1000 К:
а) Н 2 О (г) + СО ⇄ СО 2 + Н 2
б) СО 2 + С (гр) ⇄ 2СО;
c) N 2 + 3H 2 ⇄ 2NH 3 .
Изменениями ΔH o и S о от температуры пренебречь.
61. Для некоторой самопроизвольно протекающей реакции Δ S < О. Как будет изменяться константа равновесия с повышением температуры: а) увеличиваться, б) уменьшаться, в) по данным задачи нельзя определить.
62. Не пользуясь вычислениями, установить знак ΔS o следующих процессов:
а) 2NH 3(г) ⇄ N 2(г) + H 2(г) ;
б) CO 2(кр) ⇄ CO 2(г) ;
в) 2NO (г) + O 2 (г) = 2NO 2(г) ;
г) 2Н 2 S (г) + 3O 2 = 2H 2 O (ж) + 2SO 2(г) ;
д) 2СН 3 ОН (г) + 3О 2(г) = 4H 2 O (г) + 2СО 2(г) .
63. В каком из следующих случаев реакция возможна при любых температурах: а) ΔН°< 0, ΔS°> 0; б) Δ Н°<0, ΔS°<0; в) Δ Н°>0, ΔS°> 0 ?
64. В каком из следующих случаев реакция неосуществима при любых температурах: а) ΔН°> 0, ΔS°> 0; б) Δ Н°>0, ΔS°<0; в) Δ Н°<0, ΔS°<0 ?
65. Если ΔΗ°<0 и ΔS°<0 ,
в каком из случаев реакция может протекать самопроизвольно:
а)| ΔН°| > |TΔS°|; б)| ΔН°| > |TΔS°| ?
66. Какими воздействиями на систему можно сместить равновесие систем:
а) N 2(г) + 3Н 2(г) ⇄ 2NH 3(г) ;
б) 4Fe (кр) + 3О 2(г) ⇄ 2Fe 2 O 3(кр) ;
в) SO 2 (г) + О 2(г) ⇄ 2SO 3 (г) .
67. В каком направлении произойдет смещение равновесия при повышении температуры в системах:
1) СОCl 2 ⇄ CO +Cl 2 ; ΔН°=113 кДж;
2) 2СО ⇄ СО 2 + С; ΔН°=-171 кДж;
3) 2SO 3 ⇄ 2SO 2 + O 2 ; ΔН°=192 кДж.
68. В каком направлении сместится равновесие при повышении давления в системах:
1) Н 2(г) + S (кр) ⇄ Н 2 S (г) ;
2) 2CO (г) ⇄ СО 2(г) + С (гр) ;
3) 4HCl (г) +О 2(г) ⇄ 2Н 2 О (г) + 2Cl 2(г) .
69. Как повлияет на равновесие следующих реакций:
СаСО 3(кр) ⇄ СаО (кр) + СО 2(г) ; ΔН°=178 кДж;
2СО (г) + О 2(г) ⇄ 2СО 2 ; ΔН°=-566 кДж;
N 2(г) + О 2(г) ⇄ 2NO (г) ; ΔН°=180 кДж.
а) повышение температуры,
б) повышение давления?
70. Используя справочные данные, найти приближенное значение температуры, при которой константа равновесия реакции образования водяного газа
С (гр) + Н 2 О (г) ⇄ СО (г) + Н 2(г)
равна 1. Зависимостью ΔH o и S о от температуры пренебречь.
71. Константа равновесия К р реакции СО+Сl 2 ⇄ СОCl 2 при 600 о С равна 1,67*10 -6 . Вычислять К с реакции при данной температуре.
72. Упругость диссоциации карбоната магния при 1000 К равна 42189 Па, а при 1020 К - 80313 Па. Определить тепловой эффект реакции MgCО 3 ⇄ МgО+СO 2 и температуру, при которой упругость диссоциации карбоната магния станет равной 1 Па.
Константа равновесия
Для химической обратимой реакции, представленной в общем виде:
аА+ЬВ ^dD+eE,
установлено, что, независимо от того, каковы были начальные концентрации реагентов, присутствовали или нет продукты реакции, в состоянии равновесия сохраняется постоянным отношение: где [А] /; , [В] ; „ [D] ; „ [Е] ; , - равновесные молярные концентрации реагентов и продуктов реакции; a, b, d, е - стехиометрические коэффициенты в уравнении реакции; К с - константа химического равновесия.
Константа химического равновесия зависит от температуры, природы веществ, но не зависит от концентрации реагирующих веществ, т.к. она показывает при каких соотношениях произведений концентраций реагирующих веществ в системе наступает химическое равновесие.
Данная формула является выражением закона действующих масс для равновесия, установленного Гульдбергом и Вааге (1867).
Для равновесий между газообразными веществами удобнее пользоваться не молярными концентрациями, а парциальными давлениями газообразных веществ; в этом случае константа равновесия обозначается К р («ка-эр»):
D Е Р р а pb А В
Константа равновесия, выраженная через концентрации, и константа равновесия, выраженная через парциальные давления веществ, связаны соотношением:
К р = K c RTAn,
где Ап - разность коэффициентов при формулах газообразных веществ в правой и левой частях уравнения.
При Дп=0 константы равновесия К р и К с равны.
Таким образом, константа химического равновесия представляет собой дробь, в числителе которой стоит произведение равновесных концентраций (если реакция протекает в растворе) или равновесных парциальных давлений (для реакций в газовой фазе) продуктов реакций, возведенных в степени, показатели которых равны стехиометрическим коэффициентам. А в знаменателе - произведение концентраций (или парциальных давлений) исходных веществ, возведенных в соответствующие степени.
Если протекает гетерогенная реакция
2С(Х) + 0 2 ^ 2СО,
то константа равновесия имеет вид
т.е. в выражение константы равновесия гетерогенной реакции входят равновесные концентрации веществ, находящихся только в жидкой или газообразной фазах.
Константа равновесия определяет полноту протекания реакции к моменту достижения равновесного состояния: чем больше значение константы равновесия, тем в большей степени в равновесной реакционной смеси преобладают продукты реакции, тем больше выход продуктов реакции.
Смещение химического равновесия. Принцип Лe Шателье
При изменении условий, в которых находится система (температура, давление, концентрация), химическое равновесие нарушается. Через некоторое время в системе устанавливается новое химическое равновесие, соответствующее новым условиям. Переход от одного равновесного состояния в другое называется сдвигом или смещением равновесия.
Направление смещения химического равновесия в результате изменения внешних условий определяется принципом Jle Шателье: если на систему, находящуюся в истинном равновесии, воздействовать извне, изменяя какое- либо из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Кратко этот принцип формулируется так: если находящаяся в равновесии система подвергается внешнему воздействию, то равновесие смещается в таком направлении, которое способствует ослаблению этого воздействия.
Учебные вопросы
Состояние равновесия
Константа равновесия
Расчет равновесных концентраций
Смещение химического равновесия. Принцип Ле Шателье
Состояние равновесия
Реакции, протекающие при одних и тех же условиях одновременно в противоположных направлениях, называются обратимыми .
Рассмотрим обратимую реакцию, которая протекает в закрытой системе
Скорость прямой реакции описывается уравнением:
 пр
= k
пр
[A]
[B],
пр
= k
пр
[A]
[B],
где
 пр
–
скорость прямой реакции;
пр
–
скорость прямой реакции;
k пр – константа скорости прямой реакции.
С
течением времени концентрации реагентов
А
и В
уменьшаются, скорость реакции падает
(рис.1, кривая
 пр).
пр).
Реакция между А и В приводит к образованию веществ C и D , молекулы которых при столкновениях могут вновь дать вещества А и В .
Скорость обратной реакции описывается уравнением:
 обр
= k
обр
[С] [D],
обр
= k
обр
[С] [D],
где
 обр
–
скорость обратной реакции;
обр
–
скорость обратной реакции;
k обр – константа скорости обратной реакции.
По
мере того как концентрации веществ C
и D
возрастают, скорость обратной реакции
растет (рис.1, кривая
 обр).
обр).

Рис.1. Изменение скоростей прямой и обратной реакций во времени
Через некоторое время скорости прямой и обратной реакций становятся равными:
 пр
=
пр
=
 обр
обр
Такое состояние системы называется состоянием равновесия .
В состоянии равновесия концентрации всех его участников перестают меняться во времени . Такие концентрации называютсяравновесными .
Химическое равновесие – это динамическое равновесие. Неизменность концентраций веществ, присутствующих в закрытой системе, есть следствие непрерывно идущих химических процессов. Скорости прямой и обратной реакции не равны нулю, а нулю равна наблюдаемая скорость процесса.
Равенство скоростей прямой и обратной реакций – это кинетическое условие химического равновесия.
2. Константа равновесия
При равенстве скоростей прямой и обратной реакции
 пр
=
пр
=
 обр
обр
справедливо равенство
k пр [A] [B] = k обр [С] [D],
где [A ], [B ], [С ], [D ] – равновесные концентрации веществ.
Поскольку константы скоростей не зависят от концентраций, равенство можно записать иначе:

Отношение констант скоростей прямой и обратной реакций ( k пр / k обр ) называют константой химического равновесия:
|
|
Истинное химическое равновесие может устанавливаться только в том случае, если равновесны все элементарные стадии механизма реакции. Сколь бы сложны ни были механизмы прямой и обратной реакций, но в состоянии равновесия они должны обеспечить стехиометрический переход исходных веществ в продукты реакции и обратно. Это значит, что алгебраическая сумма всех стадий процесса равна стехиометрическому уравнению реакции, т.е. стехиометрические коэффициенты представляют собой сумму молекулярностей всех стадий механизма.
Для сложной реакции
aA + bB cC + dD
|
К с
= |
Для одной и той же температуры отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, представляет постоянную величину .
Это вторая формулировка закона действующих масс.
В выражение константы равновесия гетерогенной реакции входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
Например, выражение для константы равновесия следующей реакции
СО 2 (г) + С(тв) 2СО(г)
записывается так:
К
с
=
 .
.
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Численное значение константы равновесия определяет, каким должно быть соотношение концентраций всех реагирующих веществ при равновесии.
Изменение концентрации любого из этих веществ влечет за собой изменения концентраций всех остальных веществ. В итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Величина константы равновесия зависит от природы реагирующих веществ и температуры.
Константа равновесия, выраженная через молярные концентрации реагирующих веществ (К с ) и константа равновесия, выраженная через равновесные парциальные давления (К р ) (см. «Основы химической термодинамики»), связаны между собой соотношениями:
К р = К с RT , K c = К р / (RT ) ,
где - изменение числа газообразных молей в реакции.
Стандартное изменение энергии Гиббса равно
G Т = - RT ln K p ,
G Т = H – T S .
После приравнивания правых частей уравнений:
- RT ln K p = H – T S
ln K р = - H / (RT ) + S /R .
Уравнение не только устанавливает вид зависимости константы от температуры, но и показывает, что константа определяется природой реагирующих веществ.
Константа равновесия не зависит от концентраций (как и константа скорости реакции), механизма реакции, энергии активации, от присутствия катализаторов . Смена механизма, например, при введении катализатора, не влияет на численное значение константы равновесия, но, конечно, меняет скорость достижения равновесного состояния.






